��Ŀ����
����Ŀ����������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI===2KCl+I2����ش��������⣺

(1)ָ����ȡ��Ĺ������й�ʵ����������������ƣ�__________��________��
(2)��3 mL��ˮ�У�����1 mL���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________(ע���Թ�����ɫ��Ϊ�Ϻ�ɫ��Һ)��

(3)�Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������辭������ָ������ͼʵ��װ���еĴ���֮����(����װ�����ձ��ײ��ѵ���ʯ����)

��____________________________��
��____________________________��
���𰸡�
(1)���� ��ȡ����Һ
(2)D
(3)���¶ȼ��¶˵�ˮ�����ܲ�����Һ�У�Ӧλ��֧�ܿ�
��������(��������)��ˮ��������
��������
(1)������ҵ�����Һ����ɲ�������Һ��ͨ�����˵�ʵ�������ʵ�ֵģ������ˮ��Һת���ɺ�����л���Һ����Ҫ����ȡ�ٷ�Һ����ɡ�
(2)���Ȼ�̼���ܶȴ���ˮ���ֲ��λ���²㣬��ϵ�ˮ��CCl4������ֱ�Ϊ3 mL��1 mL�����ж�D��ȷ��
(3)������Ļ���ʵ��װ��ͼ��ԭ����֪���¶ȼ��¶˵�ˮ����Ӧλ��������ƿ��֧�ܿڴ�����������ˮ������ӦΪ�½��ϳ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��

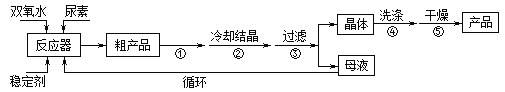
��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����
����Ŀ����п����Ҫ�ɷ�ΪZnS��������FeS��CuS��CdS���ʡ����̿����Ҫ�ɷ�Ϊ MnO2��������A12O3��SiO2��������п������Ϳ�Ϊԭ���Ʊ�Zn��MnO2������������£��м����Ĺ��岿���Ѿ���ȥ����

��֪��I.��ʯ�����н���Ԫ������Һ�о���������ʽ���ڡ�
��.���ֽ���������ȫ������pH���±���
Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�ش��������⣺
��1��������з��������Ӧ������MnO2��FeS�����Ṳ��ʱ�е���ɫ������������Һ��Ϊ�ػ�ɫ��д��MnO2��FeS�����Ṳ�ȷ�����Ӧ�Ļ�ѧ����ʽ________________________________��
��2������ڼ������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ���_______________��
��3���������MnO2����������ԭ��Ӧ�����ӷ���ʽ_________________������X������__________(����ĸ��ʾ��
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
��4�������п���ѭ�����õ�������____________���ѧʽ����
��5��MnO2��Li����LiMnO2���õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4�����ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2���ش��������⣺

�����·�еĵ����ƶ���������______������______��������ĸ����
��д��������ӵ�ص������缫��Ӧʽ_____________________________��
��6����֪��25��ʱ��HCN�ĵ��볣��K=4.9��10-10�� H2S�ĵ��볣��K1=1.3��10-7 ��K2=7.0 ��10 -15����NaCN��Һ��ͨ��������H2S���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________��


