题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1 NA |
| B.100ml 18.4mol/L的浓硫酸与足量铜加热充分反应后生成SO2的数目为0.92 NA |
| C.密闭容器中盛有0.1molN2和0.3molH2,充分反应后转移电子的数目为0.6NA |
| D.80 g NH4NO 3晶体中含有NH4+ 数目为NA |
D
解析试题分析:A、常温常压下,气体摩尔体积不是2.24L ,不能用其计算,错误;B、浓硫酸与足量铜随反应进行硫酸浓度变小,稀硫酸不与铜反应,故硫酸不能完全反应,错误;C、该反应为可逆反应,反应物不能完全反应,故转移电子数目小于0.6NA,错误;D、该晶体为离子晶体,正确。
考点:考查阿伏加德罗常数有关问题。

练习册系列答案
相关题目
下列化学用语正确的是
A.硫离子的结构示意图: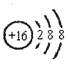 |
B.氟化镁的电子式: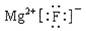 |
| C.甘氨酸的结构式:C2H5O2N |
| D.氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH)22- |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.11.2LCl2与4.25gNH3所含有的原子数相等 |
| B.2.3g甲苯和丙三醇的混合物中,含氢原子数目为0.2NA |
| C.标准状况下,2.24L溴乙烷中含共价键数目为0.7 NA |
| D.5.6gFe投入100mL 3.5mol/L硝酸中,充分反应,转移电子总数为0.3 NA |
已知2Al+2NaOH+2H2O→2NaAlO2+3H2。对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.6 mol H2,被还原的水分子数目为1.2NA |
| B.有2.7 g Al参加反应时,转移的电子数目为0.3NA |
| C.有6.72 L H2生成时,反应中转移的电子数目为0.6NA |
| D.溶液中每增加0.1mol AlO2-,Na+的数目就增加0.1NA |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
| C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NA |
| D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA |
下列叙述正确的是
| A.1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C.欲配制1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |
如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是
| A.化学反应中分子的种类发生了改变 |
| B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 |
| D.根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
 NH3 + HCl类推NH4NO3
NH3 + HCl类推NH4NO3