题目内容
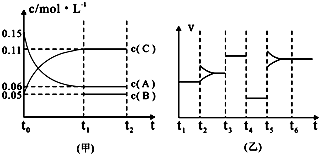
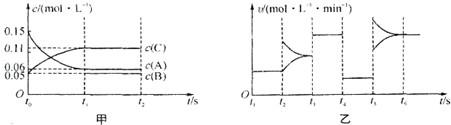
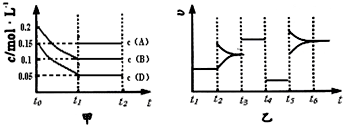
某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段 c(B)未画出].图乙为t2后改变互不相同的某一条件反应速率随时间变化的关系图,t3~t4阶段使用了催化剂.下列说法错误的是 ( )


分析:A、根据v=
计算反应速率v(C);
B、t4~t5阶段正逆反应速率减小且相等,平衡不移动,如是降低温度,平衡移动发生移动,则正逆反应速率不相等;t5~t6阶段应为升高温度.
C、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,据此判断化学方程式,根据化学方程式计算;
D、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,据此判断化学方程式.
| △c |
| △t |
B、t4~t5阶段正逆反应速率减小且相等,平衡不移动,如是降低温度,平衡移动发生移动,则正逆反应速率不相等;t5~t6阶段应为升高温度.
C、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,据此判断化学方程式,根据化学方程式计算;
D、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,据此判断化学方程式.
解答:解:A、若t1=15s,生成物C在t0~t1时间段的平均反应速率为:v(C)=
=0.004mol?L-1?s-1,故A正确;
B、t4~t5阶段正逆反应速率减小且相等,平衡不移动,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,t4~t5阶段改变的条件为减小压强;t5~t6阶段正逆反应速都增大,平衡发生移动,应为升高温度故B正确;
C、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g) B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,故C错误;
D、由C中分析可知反应方程式为3A(g) B(g)+2C(g),故D正确.
B(g)+2C(g),故D正确.
故选:C.
| 0.11mol/L-0.05mol/L |
| 15s |
B、t4~t5阶段正逆反应速率减小且相等,平衡不移动,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,t4~t5阶段改变的条件为减小压强;t5~t6阶段正逆反应速都增大,平衡发生移动,应为升高温度故B正确;
C、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
 B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为| 0.3mol |
| 0.15mol/L |
D、由C中分析可知反应方程式为3A(g)
 B(g)+2C(g),故D正确.
B(g)+2C(g),故D正确.故选:C.
点评:本题考查化学平衡移动图象、外界条件对平衡的影响、化学平衡与反应速率计算等,难度中等,注意从乙图判断各阶段的影响因素此为解答该题的关键,结合甲图中各物质的浓度,判断反应的方程式是难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
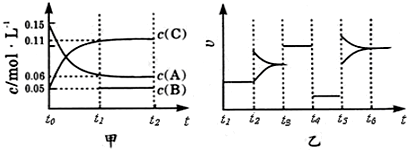
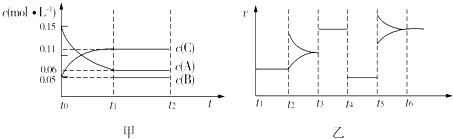
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1)阶段的c(B)变化未画出.乙图为
时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是( )
| t | 2 |

| A、若t0=15 s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004mol?L-1?s-1 |
| B、t4~t5阶段改变的条件一定为减小压强 |
| C、该容器的容积为2 L,B的起始物质的量为0.02 mol |
| D、t5~t6如阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=+100akJ?mol-1 |

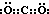
 (1)A的起始物质的量为
(1)A的起始物质的量为