题目内容
(本题共12分)
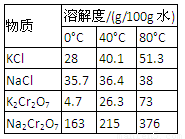
下图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答:
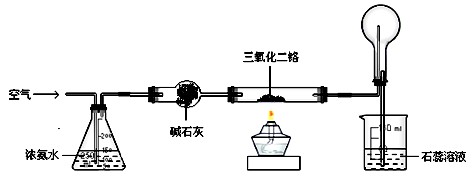
1.硬质玻璃管里发生反应的化学方程式为 。
当三氧化二铬红热时,要移去酒精灯,原因是: 。
2.圆底烧瓶里的实验现象是 ,鼓入空气的作用是 。
3.实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色 。
4.实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式: 。
5.新制的三氧化二铬催化效果较好。实验室一般用加热分解(NH4)2Cr2O7的方法制三氧化二铬,反应的化学方程式为 。
6.工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后 (填一种操作名称)。实验室里保存浓硝酸的方法是 。
(共12分)
1、4NH3 + 5O2 4NO + 6H2O(1分)
4NO + 6H2O(1分)
该反应是放热反应,温度太高可能使催化剂的活性降低(或玻璃管破裂,合理给分)(1分)
2、有红棕色气体产生(1分) 提供O2,且促进氨的挥发(2分)
3、变红色(1分)
4、NH3 + HNO3 → NH4NO3(1分)
5、(NH4)2Cr2O7  Cr2O3
+ N2↑ + 4H2O(2分)
Cr2O3
+ N2↑ + 4H2O(2分)
6、蒸馏(1分) 盛于棕色瓶,密封放于阴暗处(2分)
【解析】氨的催化氧化为放热反应,产物的NO,遇到氧气即转化为红棕色的NO2,再溶于水生成HNO3,氨气遇到硝酸得到硝酸铵。
工业上为得到高浓度的硝酸,一般的做法是向稀硝酸中加入吸水剂硝酸镁或浓硫酸,再蒸馏。

 阅读快车系列答案
阅读快车系列答案(本题共12分)下表四组物质中,每组均有4个备选项,其中有1个选项与另外3个选项属于不同的分类,请把该选项的序号挑选出来,并说明你的挑选依据,分别填入下表相应空格内。
| 组别 | 备选项 | 不同分类选项 | 挑选依据 |
| (1) | A.CO B.CO2 C.SO2 D.P2O5 |
|
|
| (2) | A. 食盐水 B.浑浊的河水 C. 带有飘尘的空气 D. 二氧化碳气体 |
|
|
| (3) | A. CaO B.SO2 C. Na2O D. CuO |
|
|
|
(4) | A. H2SO4 B. H2CO3 C. NaH2PO4 D. HNO3 |
|
|
(本题共12分)下表四组物质中,每组均有4个备选项,其中有1个选项与另外3个选项属于不同的分类,请把该选项的序号挑选出来,并说明你的挑选依据,分别填入下表相应空格内。
| 组别 | 备选项 | 不同分类选项 | 挑选依据 |
| (1) | A.CO B.CO2 C.SO2 D.P2O5 | | |
| (2) | A. 食盐水 B.浑浊的河水 C. 带有飘尘的空气 D. 二氧化碳气体 | | |
| (3) | A. CaO B.SO2 C. Na2O D. CuO | | |
| (4) | A. H2SO4 B. H2CO3 C.NaH2PO4 D. HNO3 | | |
(本题共12分)下表四组物质中,每组均有4个备选项,其中有1个选项与另外3个选项属于不同的分类,请把该选项的序号挑选出来,并说明你的挑选依据,分别填入下表相应空格内。
|
组别 |
备选项 |
不同分类选项 |
挑选依据 |
|
(1) |
A.CO B.CO2 C.SO2 D.P2O5 |
|
|
|
(2) |
A. 食盐水 B.浑浊的河水 C. 带有飘尘的空气 D. 二氧化碳气体 |
|
|
|
(3) |
A. CaO B.SO2 C. Na2O D. CuO |
|
|
|
(4) |
A. H2SO4 B. H2CO3 C. NaH2PO4 D. HNO3 |
|
|
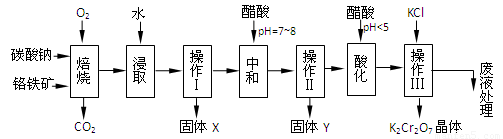
 8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
8Na2CrO4
+ 2 Fe2O3 + 8CO2↑; 2CrO42- + 2H+
2CrO42- + 2H+