��Ŀ����
����Ŀ����ͼ��һ����ѧ��Ӧ���̵�ʾ��ͼ��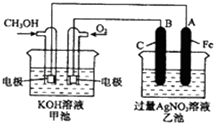
��֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O
��1����ش�ͼ�мס������ص����ƣ������װ�ã��ҳ���װ�ã�
��2����ش����е缫�����ƣ�ͨ��CH3OH�ĵ缫������ �� B��ʯī���缫�������� ��
��3��д���缫��Ӧʽ��ͨ��O2�ĵ缫�ĵ缫��Ӧʽ�� �� A��Fe���缫�ĵ缫��ӦʽΪ ��
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ ��
��5�����ҳ���A��Fe��������������5.40gʱ���׳�������������O2mL����״���£�
���𰸡�
��1��ԭ��أ���ѧ��ת��Ϊ���ܣ�,���أ�����ת��Ϊ��ѧ�ܣ�
��2������,����
��3��O2+2H2O+4e��=4OH��,4Ag++4e��=4Ag
��4��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3
4Ag+O2��+4HNO3
��5��280
���������⣺��1�����ݷ�Ӧ����ʽ֪����װ����һ��ȼ�ϵ�أ����Լ��ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã���ԭ��أ�������ӵ�Դ�������ǵ��أ�
�ʴ�Ϊ��ԭ��أ���ѧ��ת��Ϊ���ܣ������أ�����ת��Ϊ��ѧ�ܣ�
��2������2CH3OH+3O2+4KOH=2K2CO3+6H2O֪��CH3OH����������Ӧ�����Ըõ缫�Ǹ�����O2 ������ԭ��Ӧ�����Ըõ缫��������ʯī��ԭ��ص���������������ʯī�缫��������
�ʴ�Ϊ������������
��3������2CH3OH+3O2+4KOH=2K2CO3+6H2O֪��CH3OH����������Ӧ�����Ըõ缫�Ǹ�����O2 �õ��Ӻ�ˮ��Ӧ�������������ӣ�������ԭ��Ӧ�����Ըõ缫��������ʯī��ԭ��ص���������������ʯī�缫�������õ缫�Ϸ���������Ӧ�����缫���������õ缫�������ӵõ��ӷ�����ԭ��Ӧ��
�ʴ�Ϊ��O2+2H2O+4e��=4OH��4Ag++4e��=4Ag
��4���ҳ������ӷŵ�˳��Ϊ�������� Ag+��H+��������OH����NO3 ����
�ʴ�Ϊ��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3
4Ag+O2��+4HNO3
��5�����ݵ�ʧ��������ȣ����������Ĺ�ϵʽΪ��
O2������������ | 4Ag |
22.4L | ��4��108��g |
280mL | 5.40g |
�ʴ�Ϊ 280.
��1����������ת����ʽ�ж�װ�ã�
��2�����ݷ����ķ�Ӧ�����жϵ缫��
��3������ԭ��ص�����������ԭ��Ӧ�����ص�����������ԭ��Ӧ������д�缫����ʽ���ɣ�
��4�����ݵ��������ӵķŵ�˳����д�ܷ���ʽ��
��5�����ݵ���غ���м���.

 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�����Ŀ��ij��ѧ��ȤС�����ʵ��,��Ũ������ͭ�ķ�Ӧ��ȡSO2���������ʵ��̽��,ͬʱ�������NaHSO3,ʵ��װ������ͼ��ʾ:
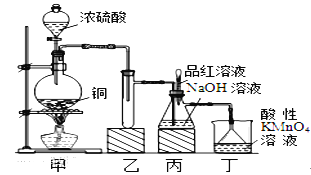
(1)װ�ü��з�����Ӧ�Ļ�ѧ����ʽ��________________,װ���ҵ�������___________��
(2)װ�ö���������������Ⱦ������SO2����,�䷴Ӧ�����ӷ���Ϊ___________________��
(3)SO2������Ư���ԡ���ԭ�Ժ������ԡ���SO2ͨ����ˮ��,SO2���ֵ���__________��,��ѧ��Ӧ����ʽΪ_________________________________��
(4)��Ӧ������,�����еι����Ʒ����Һ������ƿ,������Ϊ_____________,����Һ�е�NaOH��ȫת��Ϊ��NaHSO3��
(5)������û�м���Ʒ����Һ,����ȷ�ж����������Ƿ���ȫת�������пɹ�ѡ����������Լ�:�ձ����Թܡ�����������ͷ�ι�; 2mol/L���ᡢ2mol/L���ᡢ1mol/L�Ȼ�����Һ��1 mol/L����������Һ��Ʒ����Һ������ˮ�������ʵ��̽�����պ�������Ƿ����NaHSO3��Na2SO3,��ʵ�������Ԥ�ڵ�ʵ������ͽ��������±��С�
ʵ����� | Ԥ����������� |
����1:ȡ��������Һ�����Թ���,�μӹ���1 mol/L�Ȼ�����Һ������һ��ʱ���,�õ���ҺA����B�� | ���գ� |
����2:������B�м�������ˮϴ�ӳ���,���ú���ȥ�ϲ���Һ,��������2��(������)Ʒ��,�ٵμ�__________________�� | ��Ʒ����ɫ(��������),��˵������Na2SO3�� |
����3:���Թ�ȡ����A,�����м������___________�� | �����ɰ�ɫ����,��˵����NaHSO3���� |