题目内容
以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如下:
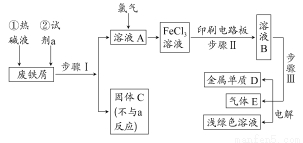
(1)试剂a应选用 (填写名称);
(2)步骤I用到的主要玻璃仪器有漏斗、 (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式: ;
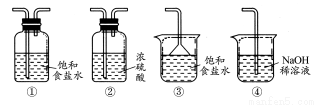
(4)实验室制取气体E的离子方程式是 ,欲对气体E进行干燥和吸收,需选用下列装置中的 (填写序号);
(5)如何用化学方法检验气体E? 。
(1)稀盐酸
(2)烧杯、玻璃棒
(3)2FeCl3+Cu=2FeCl2+CuCl2
(4) MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;②④
Mn2++Cl2↑+2H2O;②④
(5)将湿润的KI?淀粉试纸靠近集气瓶口,试纸变蓝,证明该气体为Cl2。
【解析】分析流程中的物质及其化学反应,废铁屑中加入热碱液是为了除去铁屑表面的油污,与Fe反应生成Fe2+的试剂只能选用HCl,才能由A经Cl2氧化后生成FeCl3,若换成H2SO4、HNO3等其他酸,则引入SO42-、NO3-等杂质。过滤需用的玻璃仪器有:漏斗、烧杯、玻璃棒;2FeCl3+Cu=2FeCl2+CuCl2,则B中含有FeCl2、CuCl2、FeCl3等溶质,将其电解时,根据阳离子放电顺序先析出Cu,阳极生成Cl2,但是由于氧化性Fe3+ >Cu2+,则Fe3+一定放电成Fe2+后才有Cu单质析出;Cl2的实验室制法为MnO2与浓盐酸反应,则Cl2中混有HCl、H2O等杂质,干燥Cl2用②,吸收Cl2用④;Cl2的检验方法是用湿润的淀粉?KI试纸。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目