题目内容
下列实验操作中错误的是( )
| A.用酒精萃取碘水中的碘 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
A
解析试题分析:A.用酒精与水互溶不能分层无法萃取碘水中的碘,错误。B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处,正确。C.分液操作时,为尽可能使液体充分分离,分液漏斗中下层液体从下口放出,上层液体从上口倒出,正确。D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上,正确。
考点:本题考查化学实验中实验操作注意事项。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是( )
| 选项 | 目 的 | 实验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
对于某纯净物溶液中离子的检验及结论正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入足量稀盐酸无现象,再加入氯化钡溶液,有白色沉淀产生,一定有SO42- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
利用下列实验装置进行的相应实验,不能达到实验目的的是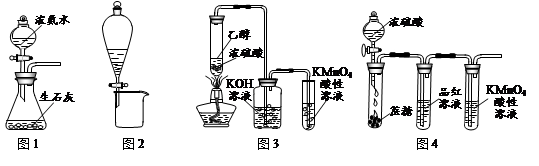
| A.图1所示装置可制取氨气 |
| B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.图3所示装置可制取乙烯并验证其易被氧化 |
| D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
从海水中提取镁的工业生产流程如下: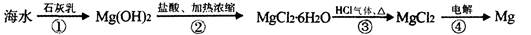
下列说法错误的是
| A.此法的优点之一是原料来源丰富 |
| B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C.步骤①②③的目的是从海水中提取无水MgCl2 |
| D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
下列实验操作与预期目的或所得结论一致的是
| A.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,证明该溶液中一定不含有K+ |
| B.向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
| C.向某溶液中加入硝酸酸化的Ba(NO3)2溶液,出现白色沉淀,说明该溶液一定含有SO42- |
| D.在乙酸、乙醇与乙酸乙酯的混合物中加入适量饱和烧碱溶液充分混合后分液,可得到较纯净的乙酸乙酯 |
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
| 选项 | 目的 | 实验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
下列实验设计能完成或实验结论合理的是 ( )。
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾淀粉试纸检验,观察试纸颜色的变化 |
| B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 |
| C.测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.用新制氢氧化铜悬浊液可以鉴别甲酸、甲酸甲酯、乙酸、乙酸乙酯四种物质 |
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。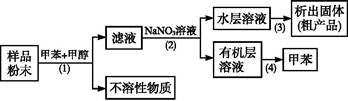
下列说法中错误的是( )
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |