题目内容
已知常温下反应①、②、③的平衡常数关系为K1>K3>K2,据此所做以下推测合理的是( )
①NH3+H+?NH4+(平衡常数为K1) ②Ag++Cl-?AgCl(平衡常数为K2) ③Ag++2NH3?Ag(NH3)2+(平衡常数为K3)
①NH3+H+?NH4+(平衡常数为K1) ②Ag++Cl-?AgCl(平衡常数为K2) ③Ag++2NH3?Ag(NH3)2+(平衡常数为K3)
分析:根据题目中的信息可知,平衡常数越大,两种物质越易反应,根据平衡常数关系为K1>K3>K2,则在溶液中离子发生反应的先后顺序为NH3+H+?NH4+,Ag++2NH3?[Ag(NH3)2]+,Ag++Cl-?AgCl再结合物质的性质分析.
解答:解:A、根据K3>K2,说明Ag++2NH3?[Ag(NH3)2]+容易发生,即氯化银能溶于氨水,故A正确;
B、根据K3>K2,说明Ag++2NH3?[Ag(NH3)2]+容易发生,Ag++Cl-?AgCl不容易发生,所以银氨溶液中加入少量氯化钠没有白色沉淀,故B错误;
C、K1最大,所以NH3+H+?NH4+容易发生,反应后溶液中有较多的Ag+,Ag+与Cl-反应生成AgCl白色沉淀,故C错误;
D、K1最大,所以NH3+H+?NH4+容易发生,所以银氨溶液在酸性条件下不能稳定存在,故D错误;
故选:A.
B、根据K3>K2,说明Ag++2NH3?[Ag(NH3)2]+容易发生,Ag++Cl-?AgCl不容易发生,所以银氨溶液中加入少量氯化钠没有白色沉淀,故B错误;
C、K1最大,所以NH3+H+?NH4+容易发生,反应后溶液中有较多的Ag+,Ag+与Cl-反应生成AgCl白色沉淀,故C错误;
D、K1最大,所以NH3+H+?NH4+容易发生,所以银氨溶液在酸性条件下不能稳定存在,故D错误;
故选:A.
点评:本题是一道信息给予题,注意根据题目中的信息结合已有的知识分析解答,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
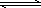 NH4+(平衡常数为K1)
NH4+(平衡常数为K1)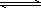 AgCl(平衡常数为K2)
AgCl(平衡常数为K2)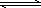 Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3) NH4+ (平衡常数为K1) ②Ag++Cl—
NH4+ (平衡常数为K1) ②Ag++Cl—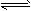 NH4+ (平衡常数为K1)②Ag++Cl-
NH4+ (平衡常数为K1)②Ag++Cl-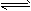 AgCl(平衡常数为K2)
AgCl(平衡常数为K2)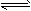 Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3)