题目内容
 为探究乙烯与溴的加成反应:甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量浓硫酸的还原气体,由此他提出必须先除去,再与溴水反应.
为探究乙烯与溴的加成反应:甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量浓硫酸的还原气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题:
(1)甲同学设计的实验
(2)乙同学推测此乙烯中必定含有的一种杂质气体,它与溴水反应的化学方程式是
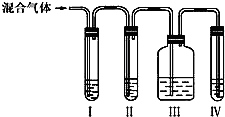
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是Ⅰ
(选填序号).
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
②乙设计的实验中能确定生成了乙烯的现象是
(3)为验证乙烯与溴水的反应是加成反应而不是取代反应,丙同学提出可将上述乙除杂后的气体通入溴水中,用pH试纸测反应后溶液的酸碱性,你认为是否合理
(4)乙烯通入溴水中,观察到的现象是
分析:(1)乙醇和浓硫酸作原料制取的乙烯中含有二氧化硫等物质,二氧化硫能使溴水褪色;
(2)有刺激性气味的气体是二氧化硫,二氧化硫能被溴氧化生成硫酸;
①要验证乙烯之前先检验二氧化硫、除去二氧化硫、检验是否除尽二氧化硫,最终用酸性高锰酸钾溶液检验乙烯;
②III中品红溶液不褪色,而IV中酸性高锰酸钾溶液褪色;
(3)如果发生取代反应,则有溴化氢生成,溶液呈强酸性,根据溶液pH确定发生反应类型;
(4)乙烯和溴发生加成反应生成油状物质.
(2)有刺激性气味的气体是二氧化硫,二氧化硫能被溴氧化生成硫酸;
①要验证乙烯之前先检验二氧化硫、除去二氧化硫、检验是否除尽二氧化硫,最终用酸性高锰酸钾溶液检验乙烯;
②III中品红溶液不褪色,而IV中酸性高锰酸钾溶液褪色;
(3)如果发生取代反应,则有溴化氢生成,溶液呈强酸性,根据溶液pH确定发生反应类型;
(4)乙烯和溴发生加成反应生成油状物质.
解答:解:(1)乙醇和浓硫酸反应,在一定条件下可以生成乙烯、乙醚,同时可能生成二氧化硫等还原性气体,使酸性高锰酸钾溶液褪色,对乙烯的检验造成干扰,所以甲同学的实验不能说明乙烯与溴水发生加成反应,
故答案为:不能;乙醇和浓硫酸为原料制取乙烯时,生成的气体中可能含有二氧化硫,二氧化硫也能使溴水褪色;
(2)二氧化硫、溴水发生氧化还原反应生成硫酸和氢溴酸,反应方程式为2H2O+Br2+SO2=H2SO4+2HBr,故答案为:2H2O+Br2+SO2=H2SO4+2HBr;
①验证过程中必须排除二氧化硫的干扰,所以先除去二氧化硫,I中盛放品红溶液检验二氧化硫、II中盛放氢氧化钠溶液除去二氧化硫、III中盛放品红溶液检验二氧化硫是否除尽,IV中盛放酸性高锰酸钾检验乙烯的性质,故答案为:A;B;A;D;
②III中溶液不褪色,说明剩余气体中不含二氧化硫,IV中酸性高锰酸钾溶液褪色,说明乙烯能使酸性高锰酸钾褪色,故答案为:III中品红溶液不褪色,IV中酸性高锰酸钾溶液褪色;
(3)若乙烯和溴发生取代反应,则该反应中有溴化氢生成,用pH试纸测反应后溶液应该呈酸性,如果溶液没有呈酸性,则证明发生加成反应,所以丙同学的设计合理,
故答案为:合理;若发生取代反应,必有溴化氢生成,溶液呈酸性;
(4)溴和乙烯发生加成反应生成1,2-二溴乙烷,且1,2-二溴乙烷密度较大,所以下层有无色油状液体生成,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溴水褪色,下层有无色油状物生成;CH2=CH2+Br2→CH2BrCH2Br.
故答案为:不能;乙醇和浓硫酸为原料制取乙烯时,生成的气体中可能含有二氧化硫,二氧化硫也能使溴水褪色;
(2)二氧化硫、溴水发生氧化还原反应生成硫酸和氢溴酸,反应方程式为2H2O+Br2+SO2=H2SO4+2HBr,故答案为:2H2O+Br2+SO2=H2SO4+2HBr;
①验证过程中必须排除二氧化硫的干扰,所以先除去二氧化硫,I中盛放品红溶液检验二氧化硫、II中盛放氢氧化钠溶液除去二氧化硫、III中盛放品红溶液检验二氧化硫是否除尽,IV中盛放酸性高锰酸钾检验乙烯的性质,故答案为:A;B;A;D;
②III中溶液不褪色,说明剩余气体中不含二氧化硫,IV中酸性高锰酸钾溶液褪色,说明乙烯能使酸性高锰酸钾褪色,故答案为:III中品红溶液不褪色,IV中酸性高锰酸钾溶液褪色;
(3)若乙烯和溴发生取代反应,则该反应中有溴化氢生成,用pH试纸测反应后溶液应该呈酸性,如果溶液没有呈酸性,则证明发生加成反应,所以丙同学的设计合理,
故答案为:合理;若发生取代反应,必有溴化氢生成,溶液呈酸性;
(4)溴和乙烯发生加成反应生成1,2-二溴乙烷,且1,2-二溴乙烷密度较大,所以下层有无色油状液体生成,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溴水褪色,下层有无色油状物生成;CH2=CH2+Br2→CH2BrCH2Br.
点评:本题考查了探究乙烯的制取和性质,明确物质的性质是解本题关键,同时考查学生对实验设计的缜密性,根据物质的性质来分析解答,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
(本题10分)
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH浓硫酸170 ℃CH2===CH2+H2O),将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的 杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。
杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是________(填编号)。
| A.使溴水褪色的反应,未必是加成反应 |
| B.使溴水褪色的反应,就是加成反应 |
| C.使溴水褪色的气体,未必是乙烯 |
| D.使溴水褪色的气体,就是乙烯 |
(3)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取哪些方法?