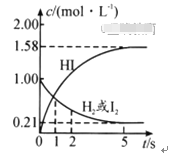
题目内容
【题目】SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)![]() 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
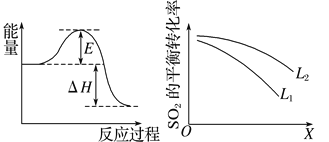
(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________,
②L1________(填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________。
【答案】杀菌、消毒、漂白织物、作抗氧化剂等 E+|ΔH | 温度 < 2.43×104 MPa-1 SO2+2H2O-2e- === 4H++SO42-
【解析】
(1)根据SO2性质分析其用途;
(2)活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,图中的较高的虚线表示SO2与O2反应生成SO3的反应分子活化状态的能量,该反应的逆反应同样遵守相同的能量要求,逆反应物总能量提升到该活化能位置后反应进行并放热;
(3)①该反应是放热反应,也是气体体积减小的反应,根据温度和压强对平衡的影响来分析;
②压强越高SO2转化率越高;
(4)列出三段式,找出平衡时各组分的分压,代入公式Kp=![]() 计算;
计算;
(5)原电池负极发生氧化反应,元素化合价升高,以此分析。
(1)SO2可用于生产硫以及作为杀虫剂、杀菌剂、漂白剂和还原剂,具有较强的还原性。
故答案为:杀菌、消毒、漂白织物、作抗氧化剂等;
(2)活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,图中的较高的虚线表示SO2与O2反应生成SO3的反应分子活化状态的能量,该反应的逆反应同样遵守相同的能量要求,逆反应物总能量提升到该活化能位置后反应进行并放热,故该反应需要的活化能为E+|ΔH |。
故答案为:E+|ΔH | ;
(3)①由图可知,该反应是放热反应,温度升高会使平衡向逆反应方向移动,SO2转化率降低,而该反应是气体体积减小的反应,压强增大会使反应向正反应方向移动,SO2转化率提高,故X表示温度。
②压强越高SO2转化率越高,故L2>L1。
故答案为:温度;<;
(4)该体系处于体积不变的密闭容器中,故随着气体物质的量改变,总压强有所变化。该反应体系物质的量转化为:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始(mol) 0.2 0.1 0
转化(mol) 0.18 0.09 0.18
平衡(mol) 0.02 0.01 0.18
可知体系中气体总物质的量从0.3mol减少到0.21,故整体的压强降低为0.07 MPa。P分=0.07 MPa ![]() ,分别代入公式:SO2、O2和 SO3分压分别为:0.0067 MPa、0.0033 MPa和0.06MPa,
,分别代入公式:SO2、O2和 SO3分压分别为:0.0067 MPa、0.0033 MPa和0.06MPa,
Kp=![]() =
=![]() =2.43×104 MPa-1。
=2.43×104 MPa-1。
故答案为:2.43×104 MPa-1 ;
(5)多孔材料电极不参与反应,只提供电子的传导,SO2与O2反应,失去电子,故通入该电池负极,化合价上升,正极O2得电子,化合价下降,故负极的电极反应式为SO2+2H2O-2e- === 4H++SO42-。
故答案为:SO2+2H2O-2e- === 4H++SO42-。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列实验操作和现象所得到的结论不正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO |
B | 用pH计测定等浓度的Na2CO3和NaClO溶液的pH | 后者pH比前者的大 |
C | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
A. AB. BC. CD. D
【题目】含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为______________________。
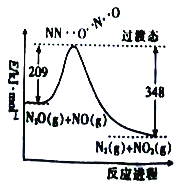
(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。