题目内容
为了确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验.
(1)若取ag样品,向其中加入足量的氢氧化钠溶液,测得生成的气体为bL(标况).反应的离子方程式为______,样品中铝的物质的量为______mol;
(2)若取ag样品,在高温下能恰好完全反应,该反应的化学方程式为______,样品中氧化铁与铝的质量比为______;
(3)待(2)中反应产物冷却后,往其中加入足量的盐酸,测得生成的气体体积为cL(标况),则该气体与(1)中所得的气体的体积比c:b=______.
解:(1)铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
标准状况下bL氢气的物质的量为 =
=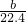 mol,由方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知,样品中铝的物质的量为
mol,由方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知,样品中铝的物质的量为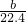 mol×
mol× =
= mol,
mol,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑; ;
;
(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为2Al+Fe2O3 2Fe+Al2O3;由二者恰好反应,根据方程式可知,
2Fe+Al2O3;由二者恰好反应,根据方程式可知,
质量之比等于总的相对分子质量之比,则样品中氧化铁与铝的质量比为(56×2+16×3):2×27=80:27,
故答案为:2Al+Fe2O3 2Fe+Al2O3;80:27;
2Fe+Al2O3;80:27;
(3)由方程式2Al+Fe2O3 2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
故答案为:2:3.
分析:(1)铝与氢氧化钠反应生成偏铝酸钠与氢气;根据n=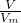 计算氢气的物质的量,利用方程式计算铝的物质的量;
计算氢气的物质的量,利用方程式计算铝的物质的量;
(2)铝与氧化铁在高温下生成铁与氧化铝;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比.注意铁与盐酸反应生成氯化亚铁.
点评:本题考查常用化学用语、根据方程式的计算等,难度不大,注意基础知识的掌握.
标准状况下bL氢气的物质的量为
 =
=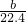 mol,由方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知,样品中铝的物质的量为
mol,由方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知,样品中铝的物质的量为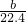 mol×
mol× =
= mol,
mol,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
 ;
;(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为2Al+Fe2O3
 2Fe+Al2O3;由二者恰好反应,根据方程式可知,
2Fe+Al2O3;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比,则样品中氧化铁与铝的质量比为(56×2+16×3):2×27=80:27,
故答案为:2Al+Fe2O3
 2Fe+Al2O3;80:27;
2Fe+Al2O3;80:27;(3)由方程式2Al+Fe2O3
 2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,
2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3,故答案为:2:3.
分析:(1)铝与氢氧化钠反应生成偏铝酸钠与氢气;根据n=
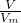 计算氢气的物质的量,利用方程式计算铝的物质的量;
计算氢气的物质的量,利用方程式计算铝的物质的量;(2)铝与氧化铁在高温下生成铁与氧化铝;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比.注意铁与盐酸反应生成氯化亚铁.
点评:本题考查常用化学用语、根据方程式的计算等,难度不大,注意基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目