题目内容
某溶液中大量存在以下五种离子:NO 、SO42-、Fe3+、H+、M,其物质的量之比为
、SO42-、Fe3+、H+、M,其物质的量之比为
n(NO )∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则 M可能为( )
)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则 M可能为( )
| A.Cl- | B.Mg2+ | C.Ba2+ | D.Na+ |
B
解析试题分析:在任何溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等,及电荷守恒。已知离子所带的电荷是负电荷:2×1+3×2=8,阳离子所带的正电荷:1×3+3×1=6,D小于阴离子所带的负电荷总数,所以该离子带有正电荷,由于其个数是1个,因此该微粒带有2个单位的正电荷。排除A、D选项。由于溶液在含有SO42-;SO42-与Ba2+会发生沉淀反应而不能大量共存,所以选项是B。
考点:考查溶液中离子的共存及电荷守恒的知识。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.0.1mol Fe在过量的C12中充分燃烧,转移的电子数为0.3NA |
| B.常温下,22.4L甲烷中含有的共价键数目为4NA |
| C.2mol SO2和1mol O2在密闭容器中催化加热,充分反应后,容器内分子总数为2NA |
| D.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA |
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是
| A.溶解后的溶液未冷却至室温就转移入容量瓶中 |
| B.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平 |
| C.洗涤烧杯和玻璃棒的溶液转移入容量瓶中 |
| D.定容时,眼睛仰视刻度线 |
根据下列各题所给出的数据,得出的结论错误的是( )
| A.同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为0.5VL |
| B.4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16 |
C.已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中氢氧化钠的质量分数为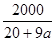 % % |
| D.将98g H2SO4溶于 1 L水中,则所制得的H2SO4溶液的物质的量浓度为1 mol/L |
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
下列说法正确的是( )
| A.固体混合物中一定含有Al,但质量不可确定 | B.固体混合物中可能含有MgCl2和AlCl3 |
| C.固体混合物中一定含有MgCl2和FeCl2 | D.固体混合物中一定含有 (NH4)2SO4、MgCl2 |
下列有关化学用语表示正确的是
A.N2的电子式: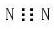 | B.氯化钠的分子式:NaCl |
C.S2-的结构示意图: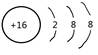 | D.乙烯的结构简式:C2H4 |
下列表述正确的是
| A.醛基的结构简式 —COH | B.聚丙烯的结构简式 |
C.四氯化碳分子的电子式 | D.丙烷分子的球棍模型 |
阿伏加德罗常数为NA,下列说法正确的是
| A.1 mol 硫酸钾中阴离子所带电荷数为NA |
| B.乙烯和环丙烷以任意比混合气体28 g,含有4 NA个氢原子 |
| C.将0.1 mol氯化铁溶于1 L水中,所得溶液含Fe3+数为0.1 NA |
| D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA |
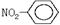
 B 硝基苯的结构简式
B 硝基苯的结构简式