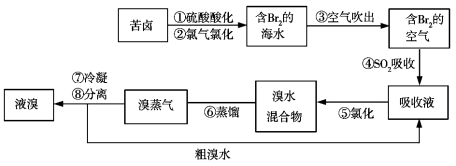
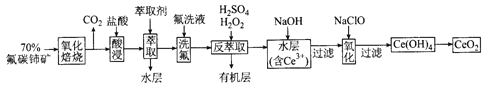
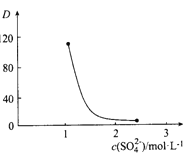
题目内容
【题目】(1)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是:________________(写离子方程式);灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:________(写离子方程式)。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3,阻止火势蔓延。其相关的离子方程式为:______________________________。
(2)碱性锌锰干电池负极的电极反应:_____________________________:甲醇燃料电池在碱性条件下负极的电极反应:__________________________________。
【答案】HCO3-+H2O![]() H2CO3+OH-,Al3+ + 3H2O
H2CO3+OH-,Al3+ + 3H2O ![]() Al(OH)3+3H+Al3+ + 3HCO3-
Al(OH)3+3H+Al3+ + 3HCO3- ![]() Al(OH)3↓+3CO2↑Zn + 2OH– 2e-== Zn(OH)22CH3OH – 12e- + 16OH— === 2CO32- +12H2O
Al(OH)3↓+3CO2↑Zn + 2OH– 2e-== Zn(OH)22CH3OH – 12e- + 16OH— === 2CO32- +12H2O
【解析】
(1)碳酸氢钠水解导致溶液呈碱性;硫酸铝水解导致其溶液呈酸性,碳酸氢钠和硫酸铝在水溶液中能相互促进水解生成二氧化碳和氢氧化铝,写出相应的离子方程式,注意碳酸氢根离子不能写成碳酸根离子和氢离子.
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2;燃料电池中,负极发生氧化反应,注意反应条件。
(1)碳酸氢钠是强碱弱酸盐,碳酸氢根离子能水解使溶液中氢氧根离子浓度大于氢离子浓度而导致其溶液呈碱性,水解离子方程式为:CO32-+H2O![]() HCO3-+OH-;硫酸铝是强酸弱碱盐能水解使溶液中氢离子浓度大于氢氧根离子浓度而导致其溶液呈酸性,Al3++3H2O
HCO3-+OH-;硫酸铝是强酸弱碱盐能水解使溶液中氢离子浓度大于氢氧根离子浓度而导致其溶液呈酸性,Al3++3H2O![]() Al(OH)3+3H+,碳酸氢钠的水溶液呈碱性,碳酸氢钠和硫酸铝在水溶液中能相互促进水解生成二氧化碳和氢氧化铝,离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
Al(OH)3+3H+,碳酸氢钠的水溶液呈碱性,碳酸氢钠和硫酸铝在水溶液中能相互促进水解生成二氧化碳和氢氧化铝,离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
(2)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OHˉ-2eˉ=Zn(OH)2;
燃料电池中,负极发生氧化反应,注意反应条件为碱性,甲醇燃料电池在碱性条件下负极的电极反应:2CH3OH – 12e- + 16OH— === 2CO32- +12H2O。

【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度