题目内容
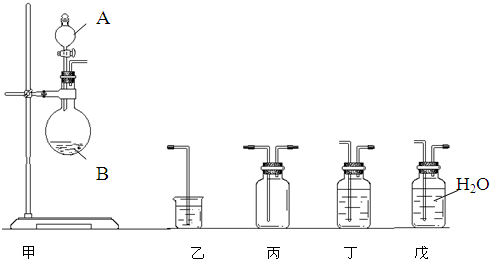
为了比较硫与碳的非金属性的强弱,某同学想通过比较两种元素的最高价氧化物对应的水化物的酸性强弱来证明硫与碳的非金属性的强弱,采用下图中的甲、乙装置进行探究,请你帮助他完成下列问题:

(1)仪器A中应盛放的药品是
(2)B中发生反应的离子方程式为:
(3)该实验能证明硫与碳的非金属性的强弱的理论依据是:

(1)仪器A中应盛放的药品是
稀H2SO4
稀H2SO4
,仪器B中应盛放的药品是Na2CO3(或可溶性碳酸盐)
Na2CO3(或可溶性碳酸盐)
,装置乙中应盛放的药品是澄清石灰水
澄清石灰水
.(2)B中发生反应的离子方程式为:
CO32-+2H+=CO2↑+H2O
CO32-+2H+=CO2↑+H2O
;在装置乙中观察到的现象是:澄清石灰水变浑浊
澄清石灰水变浑浊
.(3)该实验能证明硫与碳的非金属性的强弱的理论依据是:
由H2SO4制H2CO3即由强酸制弱酸,S的最高价氧化物对应水化物的酸性强,故S的非金属性比C强
由H2SO4制H2CO3即由强酸制弱酸,S的最高价氧化物对应水化物的酸性强,故S的非金属性比C强
.分析:通过比较C、S元素的最高价氧化物对应的水化物的酸碳酸和硫酸的酸性强弱来证明硫与碳的非金属性的强弱,结合化学反应的发生规律:强酸能制弱酸来判断,试验通过碳酸盐和硫酸的反应,加之产物的检验来充分证明硫酸酸性强于碳酸,从而得出原子的得电子能力或元素的非金属性强弱关系是:S>C.
解答:解:(1)比较C、S元素的最高价氧化物对应的水化物的酸碳酸和硫酸的酸性强弱来证明硫与碳的非金属性的强弱所需进行的反应是硫酸和碳酸盐的反应,强酸可以制得弱酸,所以可以在A中放稀硫酸,在B中放碳酸盐,可用澄清的石灰水来证明二氧化碳的生成,进而确定硫酸可以和可溶性的碳酸盐反应生成碳酸,
故答案为:稀H2SO4;Na2CO3(或可溶性碳酸盐);澄清石灰水;
(2)硫酸和可溶性的碳酸盐反应的实质是:CO32-+2H+=CO2↑+H2O,二氧化碳可以使石灰水变浑浊,
故答案为:CO32-+2H+=CO2↑+H2O;澄清石灰水变浑浊;
(3)根据硫酸可以和可溶性的碳酸盐反应可以知道硫酸酸性强于碳酸,而元素的最高价氧化物对应的水化物的酸性越强说明该元素的非金属性越强,
故答案为:由H2SO4制H2CO3即由强酸制弱酸,S的最高价氧化物对应水化物的酸性强,故S的非金属性比C强.
故答案为:稀H2SO4;Na2CO3(或可溶性碳酸盐);澄清石灰水;
(2)硫酸和可溶性的碳酸盐反应的实质是:CO32-+2H+=CO2↑+H2O,二氧化碳可以使石灰水变浑浊,
故答案为:CO32-+2H+=CO2↑+H2O;澄清石灰水变浑浊;
(3)根据硫酸可以和可溶性的碳酸盐反应可以知道硫酸酸性强于碳酸,而元素的最高价氧化物对应的水化物的酸性越强说明该元素的非金属性越强,
故答案为:由H2SO4制H2CO3即由强酸制弱酸,S的最高价氧化物对应水化物的酸性强,故S的非金属性比C强.
点评:本题通过实验的办法来考查元素周期律的有关知识,设计角度新颖,考查了学生的综合解题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验不能达到预期目的的是( )
| 实验操作 | 实验目的 | |
| A | 向NaBr溶液中滴加新制氯水 | 比较Cl2与Br2的氧化性强弱 |
| B | 用同一电路分别测定盐酸和某一元酸溶液的导电性 | 比较盐酸和该一元酸酸性的强弱 |
| C | 分别向AlCl3溶液和MgCl2溶液中加入过量NaOH溶液 | 比较镁和铝的金属性强弱 |
| D | 常温下测定同浓度Na2CO3溶液和Na2SO4溶液的Ph | 比较硫与碳的非金属性强弱 |