题目内容
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.溴单质与H2的反应比碘单质与H2的反应更剧烈 |
A
解析试题分析:A、随核电荷数的增加,碱金属元素单质的熔沸点逐渐降低,而卤族元素单质的熔沸点逐渐升高,错误;B、碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强,正确;C、钾元素的金属性比钠强,钾与水的反应比钠与水的反应更剧烈,正确;D、溴元素的非金属性比碘强,溴单质与H2的反应比碘单质与H2的反应更剧烈,正确。
考点:考查碱金属元素和卤族元素的递变规律。

练习册系列答案
 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
X、Y为短周期元素,X原子中K、L、M各电子层的电子数之比为1:4:1,Y原子比X原子少3个电子,下列叙述正确的是
| A.X、Y形成化合物表示为X2Y |
| B.X、Y形成的化合物中所含离子都是10电子微粒 |
| C.X原子半径小于Y的原子半径 |
| D.Y位于周期表中第ⅦA族,其最高正化合价为+7 |
列关于同主族元素的说法错误的是( )
| A.同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 |
| B.同主族元素随原子序数递增,单质氧化能力逐渐减弱 |
| C.同主族元素原子最外层电子数都相同 |
| D.同主族元素的原子半径,随原子序数增大而逐渐增大 |
已知五种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
A.L与Q形成的化合物属于共价化合物
B.L、M的单质与稀盐酸反应速率:M>L
C.T、Q的氢化物常温常压下均为无色气体
D.M的最高价氧化物的水化物具有两性
下列元素中基态原子的第一电离能最大的是( )
| A.B | B.C | C.N | D.O |
简单原子的原子结构可用下图形象地表示,其中?表示质子,○表示中子:①; ②
②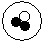 ;③
;③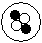 。则下列有关这三种原子的叙述中正确的是
。则下列有关这三种原子的叙述中正确的是
| A.属于不同的元素 | B.具有相同的质量数 | C.具有不同的核电荷数 | D.化学性质相似 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
| A.原子半径的大小顺序:rX>rY> rW >rQ |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
| A.钡可从氯化钠溶液中置换出金属钠 |
| B.钡可从冷水中置换出氢气 |
| C.钡可从硫酸铜溶液中置换出铜 |
| D.在溶液中Ba2+可氧化金属锌,生成Zn2+ |