题目内容
某学生在实验室做了5个实验:
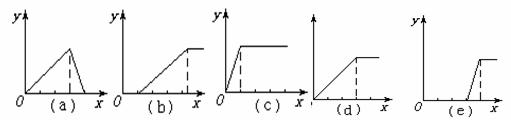
(1)在铝盐溶液中逐滴加入稀氨水直至过量,(2)在明矾溶液中加入NaOH溶液直至过量,(3)在强碱性溶液中逐滴加入铝盐溶液直至过量,(4)在偏铝酸钠溶液中通入CO2直至过量,(5)在强酸溶液中逐滴加入偏铝酸钠溶液直至过量.并根据以上实验画出下列5种图象(纵坐标为沉淀物质的量,横坐标为溶液中加入物质的量)实验与图象对立关系正确的是
- A.(1)和(a)
- B.(2)和(b)
- C.(3)和(e)
- D.(4)和(c)
CD
分析:坐标系中纵轴是沉淀的物质的量,横轴是加入物质的量.
(1)铝盐中滴入稀氨水生成沉淀氢氧化铝,根据氢氧化铝不溶于弱碱氨水,铝盐反应完后沉淀量不再变化;
(2)明矾溶液中的铝离子与滴入氢氧化钠溶液反应生成沉淀氢氧化铝,铝离子反应完后,继续滴入氢氧化钠溶液,沉淀溶解;
(3)强碱溶液中滴入铝盐开始无沉淀生成,强碱反应完后,继续滴入会生成沉淀最大量后不再变化;
(4)偏铝酸钠溶液通入二氧化碳生成沉淀,由于氢氧化铝不溶于弱酸,所以偏铝酸钠反应完后沉淀不再变化;
(5)强酸溶液中滴入偏铝酸钠,开始无沉淀生成,强酸反应完后,继续滴入偏铝酸钠会生成沉淀.
解答:(1)铝盐中滴入稀氨水生成沉淀氢氧化铝,根据氢氧化铝不溶于弱碱氨水,铝盐反应完后沉淀量不再变化;反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,根据定量关系,故d符合.
(2)铝离子与滴入氢氧化钠溶液反应生成沉淀氢氧化铝,铝离子反应完后,继续滴入氢氧化钠溶液,沉淀溶解;反应为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=[Al(OH)4]-,沉淀变化与氢氧根离子的定量关系为3:1,故a符合;
(3)强碱溶液中滴入铝盐开始无沉淀生成,强碱反应完后,继续滴入会生成沉淀最大量后不再变化,发生的反应为Al3++4OH-=[Al(OH)4]-,3[Al(OH)4]-+Al3+=4Al(OH)3↓,沉淀变化与铝盐的定量关系为3:1,故e符合;
(4)偏铝酸钠溶液通入二氧化碳生成沉淀,偏铝酸钠反应完后沉淀不再变化,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;通入二氧化碳与沉淀的定量关系为1:1,故c符合;
(5)强酸溶液中滴入偏铝酸钠,开始无沉淀生成,强酸反应完后,继续滴入偏铝酸钠会生成沉淀,发生的反应为AlO2-+4H+=Al3++2H2O;3AlO2-+Al3++6H2O=4Al(OH)3↓,沉淀变化与滴入的偏铝酸钠的定量关系为1:3,故b符合;
故选CD.
点评:本题考查了几组常见物质反应时量不同产物不同,现象不同的定量关系的分析判断和计算,主要是依据反应的定量关系判断曲线的变化,分析图象的方法是解本题的关键,需要熟练掌握各物质的反应实质.
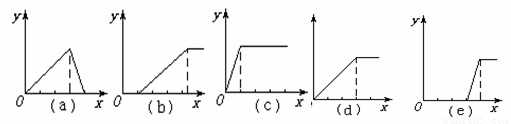
分析:坐标系中纵轴是沉淀的物质的量,横轴是加入物质的量.
(1)铝盐中滴入稀氨水生成沉淀氢氧化铝,根据氢氧化铝不溶于弱碱氨水,铝盐反应完后沉淀量不再变化;
(2)明矾溶液中的铝离子与滴入氢氧化钠溶液反应生成沉淀氢氧化铝,铝离子反应完后,继续滴入氢氧化钠溶液,沉淀溶解;
(3)强碱溶液中滴入铝盐开始无沉淀生成,强碱反应完后,继续滴入会生成沉淀最大量后不再变化;
(4)偏铝酸钠溶液通入二氧化碳生成沉淀,由于氢氧化铝不溶于弱酸,所以偏铝酸钠反应完后沉淀不再变化;
(5)强酸溶液中滴入偏铝酸钠,开始无沉淀生成,强酸反应完后,继续滴入偏铝酸钠会生成沉淀.
解答:(1)铝盐中滴入稀氨水生成沉淀氢氧化铝,根据氢氧化铝不溶于弱碱氨水,铝盐反应完后沉淀量不再变化;反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,根据定量关系,故d符合.
(2)铝离子与滴入氢氧化钠溶液反应生成沉淀氢氧化铝,铝离子反应完后,继续滴入氢氧化钠溶液,沉淀溶解;反应为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=[Al(OH)4]-,沉淀变化与氢氧根离子的定量关系为3:1,故a符合;
(3)强碱溶液中滴入铝盐开始无沉淀生成,强碱反应完后,继续滴入会生成沉淀最大量后不再变化,发生的反应为Al3++4OH-=[Al(OH)4]-,3[Al(OH)4]-+Al3+=4Al(OH)3↓,沉淀变化与铝盐的定量关系为3:1,故e符合;
(4)偏铝酸钠溶液通入二氧化碳生成沉淀,偏铝酸钠反应完后沉淀不再变化,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;通入二氧化碳与沉淀的定量关系为1:1,故c符合;
(5)强酸溶液中滴入偏铝酸钠,开始无沉淀生成,强酸反应完后,继续滴入偏铝酸钠会生成沉淀,发生的反应为AlO2-+4H+=Al3++2H2O;3AlO2-+Al3++6H2O=4Al(OH)3↓,沉淀变化与滴入的偏铝酸钠的定量关系为1:3,故b符合;
故选CD.
点评:本题考查了几组常见物质反应时量不同产物不同,现象不同的定量关系的分析判断和计算,主要是依据反应的定量关系判断曲线的变化,分析图象的方法是解本题的关键,需要熟练掌握各物质的反应实质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(1)某学生在实验室做了5个实验
①在铝盐溶液中逐滴加入稀氨水直至过量,
②在明矾溶液中加入NaOH溶液直至过量,
③在强碱性溶液中逐滴加入铝盐溶液直至过量,
④在偏铝酸钠溶液中通入CO2直至过量,
⑤在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。
并根据以上实验画出下列5种图象(纵坐标为沉淀的物质的量,横坐标为溶液中加入物质的量)实验与图象对应关系正确的是:___________。
| A.①和(a) | B.②和(b) | C.③和(e) | D.④和(c) |
(2)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,
请回答下列问题:
(a)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__________________________;
(b)实验④中的现象为:______________________________ ;
(c)实验②③反应的离子方程式分别是:
______ ______、 ______。