题目内容
已知某主族金属元素X的原子核内质子数和中子数之比为1:1,含该金属阳离子0.192g的溶液恰好能将20mL0.4mol/L的Na2CO3溶液中的CO32-全部沉淀,推断X是什么元素及在周期表中的位置。
X为镁,位于第3周期第ⅡA族
周期表中质子数与中子数相等的金属元素只有Mg和Ca两种,它们都是+2价金属。设金属的相对原子质量为M,由关系式 X2+~Na2CO3得:M:1=0.192:(0.4×0.02),解得M=24。则X为镁,位于第3周期第ⅡA族。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
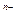 能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强
能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强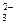 、XO
、XO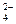 和X2O
和X2O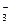 和XO
和XO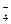 ,则X、Y一定在同一周期
,则X、Y一定在同一周期