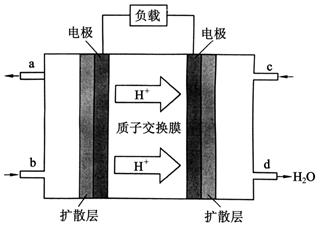
题目内容
将解析:由于已知反应前混合物的质量和反应后固体的质量,所以,有可能存在过量问题。
若
NaOH+NaHCO3![]() Na2CO3+H2O Δm
Na2CO3+H2O Δm
124 18
x=![]() =
=
因
所以,NaOH过量,NaHCO3完全反应。
NaOH+NaHCO3![]() Na2CO3+H2O Δm
Na2CO3+H2O Δm
84 18
m(NaHCO3) (18.4-16.6) g
m(NaHCO3)=![]() =
=
m(NaOH)=
w(NaOH)=![]() ×100%=54.3%。
×100%=54.3%。
答案:原混合物中NaOH的质量分数为54.3%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 HCO3-+OH-
HCO3-+OH- ?CH3OH(g)。
?CH3OH(g)。