题目内容
(16分)芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1mol H2,若1 mol C与NaHCO3完全反应,也产生1 mol气体,E可以使溴的四氯化碳溶液褪色。
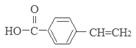
(1)③的反应类型是 ,D的结构简式是 。
(2)E中所含官能团的名称为 。
(3)写出对应的化学方程式
反应① ;
反应④ ;
反应⑤ 。
(4)现有C和E的混合物n mol,在空气中完全燃烧消耗O2 L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为: 。
(1)氧化反应;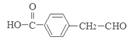 (2)碳碳双键、羧基
(2)碳碳双键、羧基
(3)① +2NaOH
+2NaOH
 +NaBr+H2O
+NaBr+H2O
④

 +H2O
+H2O
⑤n 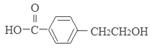

 +(n-1)H2O
+(n-1)H2O (4)224n, 5n -
(4)224n, 5n -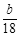 (或
(或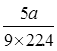 -
-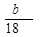 )
)
解析试题分析:由物质之间的转化关系可知A是 ;B是
;B是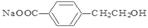 ;C是
;C是 ;D是
;D是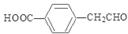 ; C在浓硫酸作用下发生消去反应产生的E是
; C在浓硫酸作用下发生消去反应产生的E是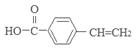 ;由于C中含有羧基和羟基,实验发生缩聚反应产生高聚物G:
;由于C中含有羧基和羟基,实验发生缩聚反应产生高聚物G: 。(1)③的反应类型是氧化反应;D的结构简式是
。(1)③的反应类型是氧化反应;D的结构简式是 ;(2)E中所含官能团的名称为碳碳双键、羧基;(3)反应①对应的化学方程式是
;(2)E中所含官能团的名称为碳碳双键、羧基;(3)反应①对应的化学方程式是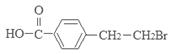 +2NaOH
+2NaOH
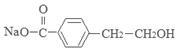 +NaBr+H2O;反应④对应的化学方程式是
+NaBr+H2O;反应④对应的化学方程式是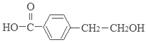

 +H2O;反应⑤对应的化学方程式是
+H2O;反应⑤对应的化学方程式是
n 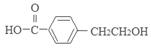

 +(n-1)H2O(4)C的分子式是C9H10O3;E分子式是C9H8O2;每1mol的混合物完全燃烧消耗氧气的物质的量是10mol,所以n mol,在空气中完全燃烧消耗O210nmol,由于在标准状态下的气体摩尔体积是22.4L/mol,所以10nmol O2标准状况下的体积为224nL。若生成CO2 a L(标准状况)、则含有C、E的物质的量是
+(n-1)H2O(4)C的分子式是C9H10O3;E分子式是C9H8O2;每1mol的混合物完全燃烧消耗氧气的物质的量是10mol,所以n mol,在空气中完全燃烧消耗O210nmol,由于在标准状态下的气体摩尔体积是22.4L/mol,所以10nmol O2标准状况下的体积为224nL。若生成CO2 a L(标准状况)、则含有C、E的物质的量是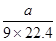 mol;H2O
mol;H2O 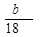 mol;假设混合物中E的物质的量为x则C的物质的量为(
mol;假设混合物中E的物质的量为x则C的物质的量为(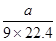 -x)mol。则混合物产生水的物质的量为4x+5(
-x)mol。则混合物产生水的物质的量为4x+5(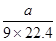 -x)=
-x)= 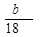 ,所以x=
,所以x= 。或假设E的物质的量为x,则C的物质的量是(n-x)。4x+5(n-x)=
。或假设E的物质的量为x,则C的物质的量是(n-x)。4x+5(n-x)=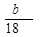 ,所以x=
,所以x=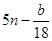 .
.
考点:考查有机物的结构、性质、相互转化、化学方程式的书写、混合物中成分含量的计算的知识。

某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/ ℃ | 34.7 | 78.5 | 118 | 77.1 |
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是 ;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: 。
球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 。
下列反应,属于取代反应的是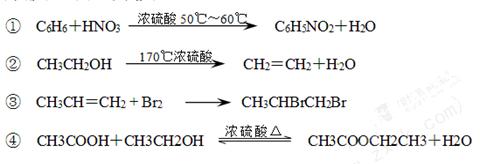
| A.①② | B.③④ | C.①③ | D.①④ |
下列物质不属于高分子化合物的是
| A.淀粉 | B.纤维素 | C.乙酸 | D.聚乙烯 |
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合“绿色化学”原子经济性要求的是
| A.乙烯发生加聚反应制得聚乙烯高分子材料 | B.用甲烷与氯气制备一氯甲烷 |
| C.用苯和液溴为原料制取溴苯 | D.用石灰石和稀盐酸反应制得二氧化碳 |
下列反应属于加成反应的是
| A.2CH3CH2OH + 2Na →2CH3CH2ONa + H2↑ |
B. |
C. |
D. |
有8种物质:①甲烷;②苯;③聚乙烯;④1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯。既能使酸性高锰酸钾溶液褪色又能与溴水因发生化学反应使之褪色的是 ( )
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑤⑦⑧ |
化学反应的实质是旧键的断裂和新键的生成,在探讨发生反应的分子中化学键在何处断裂的问题时,近代科技常用同位素示踪原子法。如有下列反应: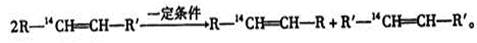 ,可以推知,化合物
,可以推知,化合物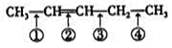 反应时断裂的化学键应是
反应时断裂的化学键应是
| A.①③ | B.①④ | C.② | D.②③ |
某种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物的结构片断为: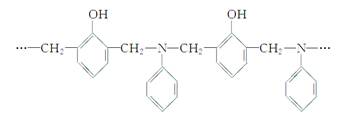
则生成该树脂的单体的种数和化学反应所属类型正确的是( )
| A.1种,加聚反应 |
| B.2种,缩聚反应 |
| C.3种,加聚反应 |
| D.3种,缩聚反应 |