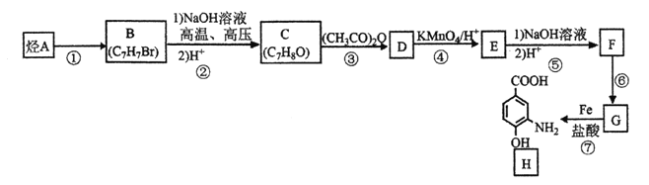
题目内容
【题目】利用电化学原理还原CO2制取ZnC2O4的装置如图所示,下列说法正确的是
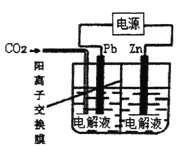
A. Zn电极是阴极
B. C2O42-从左向右移动
C. Pb电极的电极反应式是2CO2-2e-=C2O42-
D. 工作电路中每流过0.02mol电子,Zn电极质量减重0.65g
【答案】D
【解析】
Zn在阳极上失电子生成锌离子,即Zn-2e-=Zn2+,Pb电极上CO2得电子生成C2O42-,即2CO2+2e-=C2O42-,金属锌可以和硫酸之间发生反应,离子交换膜允许部分离子通过,根据电极反应式结合电子守恒来回答。
A.金属Zn失去电子生成ZnC2O4,发生氧化反应,因此Zn连接电源的正极,作阳极,A错误;
B.C2O42-带负电荷,不能通过阳离子交换膜,因此不能从左向右移动,B错误;
C. Pb电极上CO2得电子生成C2O42-,即2CO2+2e-=C2O42-,C错误;
D.Zn在阳极上失电子生成锌离子,即Zn-2e-=Zn2+,每反应产生2mol电子,反应消耗1molZn,溶解的金属Zn的质量是65g,若工作电路中每流过0.02 mol电子,Zn电极质量减重0.65g,D正确;
故合理选项是D。

练习册系列答案
相关题目