题目内容
已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类肯定不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,它们的阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)====c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-))
【答案】
C
【解析】
试题分析:由题意可知H2A是弱酸,因此NaHA溶液中既存在电离平衡(HA-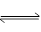 H++A2-)又存在水解平衡(HA-+H2O
H++A2-)又存在水解平衡(HA-+H2O H2A+OH-),由电荷守恒可知,C正确;在Na2S水溶液中存在Na2S的两级水解平衡(S2-+H2O
H2A+OH-),由电荷守恒可知,C正确;在Na2S水溶液中存在Na2S的两级水解平衡(S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-),溶液显碱性,c(OH-)>c(H+),D错;两种溶液中存在相同的离子,A错;由于水解程度不同,物质的量浓度相同的溶液中,阴离子总数不相等,B错,所以正确的答案选C。
H2S+OH-),溶液显碱性,c(OH-)>c(H+),D错;两种溶液中存在相同的离子,A错;由于水解程度不同,物质的量浓度相同的溶液中,阴离子总数不相等,B错,所以正确的答案选C。
考点:考查弱电解质的电离平衡,盐溶液中的水解平衡及溶液中离子浓度之间的关系
点评:该题是中等难度的试题,试题综合性强,注重解题的灵活性,侧重能力的培养。有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题,特别是灵活运用基础知识解决实际问题的能力。该题难度较大,学生不易得分。

练习册系列答案
相关题目
 H++A2-回答下列问题:
H++A2-回答下列问题: H++SO42-.
H++SO42-. H++A2-回答下列问题:
H++A2-回答下列问题: