题目内容
固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。
⑴推测Al2O3基质中掺入Cr3+的发光原理。
⑵Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。
⑴推测Al2O3基质中掺入Cr3+的发光原理。
⑵Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。
⑴Al3+和O2-是满壳层电子结构,能隙大,电子不易激发,故无色;(2分)
掺入的Cr3+是过渡金属,具有3d电子,在晶体中置换部分Al3+形成较低的激发态能级,两个强吸收带分别吸收黄绿色及蓝色的光,只有红光透过,因而掺Cr3+的刚玉呈绚丽的红色,称为红宝石。(3分)
⑵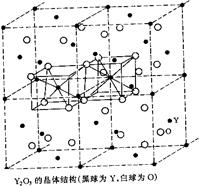 (4分)
(4分)
Y的O的配位数为6,O的Y配位数为4。(1分)
掺入的Cr3+是过渡金属,具有3d电子,在晶体中置换部分Al3+形成较低的激发态能级,两个强吸收带分别吸收黄绿色及蓝色的光,只有红光透过,因而掺Cr3+的刚玉呈绚丽的红色,称为红宝石。(3分)
⑵
 (4分)
(4分)Y的O的配位数为6,O的Y配位数为4。(1分)
⑴本题考察学生对主族元素、过渡金属离子构型的掌握情况。Al3+和O2-是是主族元素的阳离子和阴离子,都属于8电子结构,价电子不易被激发,因此为无色。当部分Cr3+置换出Al3+后,由于Cr3+为d3结构,电子易被激发,只能让红光通过(红宝石的颜色),因此能发红光。
⑵由于O位于小立方体的四面体空隙,即O的配位数为4,根据化学式可知,Y的配位数为6(配位数之比与原子数成反比)。根据题意,Y为面心立方最密堆积,因此Y原子与四面体空隙数的比例为1∶2,因此O原子在四面体空隙中的占有率为3/4,根据晶胞的对称性原理,可以把晶胞划分成八个小的立方体,其中共棱的立方体是相同的,共面的立方体不同:一种小立方体中Y位于顶点和面心,O位于六个四面体的空隙;另一个共面的立方体,O也位于六个四面体空隙中,但是未占四面体空隙呈对称关系。其中四个四面体的示意图如下所示:
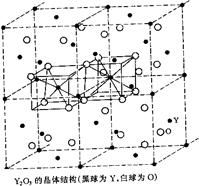
⑵由于O位于小立方体的四面体空隙,即O的配位数为4,根据化学式可知,Y的配位数为6(配位数之比与原子数成反比)。根据题意,Y为面心立方最密堆积,因此Y原子与四面体空隙数的比例为1∶2,因此O原子在四面体空隙中的占有率为3/4,根据晶胞的对称性原理,可以把晶胞划分成八个小的立方体,其中共棱的立方体是相同的,共面的立方体不同:一种小立方体中Y位于顶点和面心,O位于六个四面体的空隙;另一个共面的立方体,O也位于六个四面体空隙中,但是未占四面体空隙呈对称关系。其中四个四面体的示意图如下所示:


练习册系列答案
相关题目