题目内容
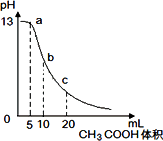
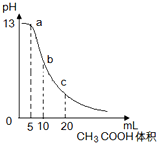 25℃时,向体积为10mL0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是( )
25℃时,向体积为10mL0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是( )B.b点处,氢氧化钠和醋酸恰好完全反应生成醋酸钠,根据质子守恒得c(CH3COOH)+c(H+)=c(OH-),故B正确;
C.c点处,溶液中的溶质是等物质的量的醋酸和醋酸钠,根据物料守恒得c(CH3COOH)+c(CH3COO-)=2c(Na+),故C正确;
D.氢氧化钠溶液和CH3COOH溶液任意比混合时,溶液都呈电中性,根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D正确;
故选A.

 阅读快车系列答案
阅读快车系列答案|
25℃时,向体积为10 mL 0.1 mol/L NaOH溶液中逐滴加入0.1 mol/L的CH3COOH溶液,曲线如下图所示,有关离子浓度关系的比较中,错误的是
| |
| [ ] | |
A. |
a点处:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
B. |
b点处:c(CH3COOH)+c(H+)=c(OH-) |
C. |
c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+) |
D. |
NaOH溶液和CH3COOH溶液任意比混合时:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
请按要求回答下列问题:
(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:_________________________。
(2)惰性电极电解饱和Na2S溶液时,在阳极附近没有看到预期的浑浊现象,探究发现,其生成了Na2Sx,则阳极反应式为:_____________________。当阳极产生1mol Sx2-时,阴极产生的气体在标准状况下的体积为_________L。(用含x的代数式表示)
(3)合成氨工业中,天然气能代替煤用于生产原料气——H2,且反应类似。请写出天然气转化为H2的两步反应方程式:______________________________________,
___________________________________________。
(4)已知:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1 = 4.2×10-7 | HClO | 3×10-8 |
| Ka2 = 5.6×10-11 |
②25℃时,0.01 mol/L NaCN溶液的pH________7;
③在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
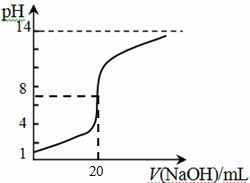
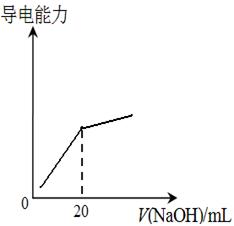
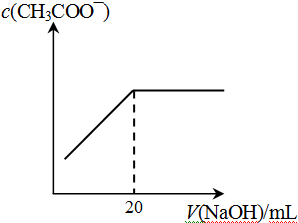
④25℃时,向20mL 0.1 mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图像正确的是_____________。

A B
C D
请按要求回答下列问题:
(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:_________________________。
(2)惰性电极电解饱和Na2S溶液时,在阳极附近没有看到预期的浑浊现象,探究发现,其生成了Na2Sx,则阳极反应式为:_____________________。当阳极产生1mol Sx2-时,阴极产生的气体在标准状况下的体积为_________L。(用含x的代数式表示)
(3)合成氨工业中,天然气能代替煤用于生产原料气——H2,且反应类似。请写出天然气转化为H2的两步反应方程式:______________________________________,
___________________________________________。
(4)已知:
|
酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
|
CH3COOH |
1.8×10-5 |
HCN |
5×10-10 |
|
H2CO3 |
Ka1 = 4.2×10-7 |
HClO |
3×10-8 |
|
Ka2 = 5.6×10-11 |
①上述四种酸中,酸性最强的是 ;
②25℃时,0.01 mol/L NaCN溶液的pH________7;
③在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
④25℃时,向20mL 0.1 mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图像正确的是_____________。


A B


C D
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ;ΔH>0
CH3COO-+H+ ;ΔH>0
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是 ;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
 ④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化
的曲线是 ;
(3)25 ℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的
NaOH溶液Vb mL至溶液恰好呈中性,则Va Vb(填“>”、“<”或“=”)
假设质检部门规定市售醋酸浓度不得低于4.8g/100mL,某同学欲用中和滴定的方法来测定某品牌的食用醋中的醋酸含量是否达标。实验具体步骤如下:①托盘天平称取一定质量NaOH并配制成500mL NaOH溶液;②用已知浓度的盐酸标准溶液准确标定该NaOH溶液的浓度;③用上述已知准确浓度的NaOH溶液测定醋酸的浓度。
(4)不直接用配置的NaOH溶液滴定样品,而要用标准盐酸先标定再滴定的原因是 ;
(5)若实验过程如下:准确量取该食用醋20.00mL,置于250mL锥形瓶中,再滴加酚酞指示剂,用标定好的0.1000mol/L的NaOH溶液滴定,酚酞指示剂由 色恰好变成__________色且 即为终点。
重复滴定多次,结果记录如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(mL) | 19.40 | 15.10 | 14.90 | 15.00 |
则该食用醋中醋酸的物质的量浓度=________ mol·L-1,是否合格 (填”是”或”否”)
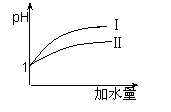 (3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水