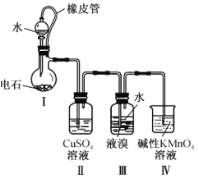
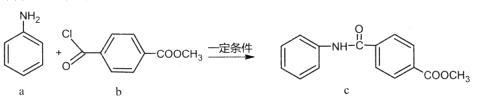
题目内容
【题目】氮化铝(AlN)的制取原理为:Al2O3+N2+3C=2AlN+3CO↑,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
(1)称取20.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出NH36.72L(标准状况)。AlN与NaOH溶液反应的化学方程式为__________;该样品中的的AlN质量分数为__________。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AlN不跟O2反应),该样品中含杂质炭__________g。
【答案】AlN+NaOH+H2O=NaAlO2+NH3↑ 61.5% 1.92
【解析】
(1)AlN跟NaOH溶液反应生成NaAlO2,并放出NH3,以此写出化学方程式,通过氨气的体积计算氨气物质的量,再通过化学方程式计算AlN的质量;
(2)通过![]() ,计算气体平均摩尔质量,判断气体成分,然后根据质量守恒列出等式计算可得。
,计算气体平均摩尔质量,判断气体成分,然后根据质量守恒列出等式计算可得。
(1)AlN跟NaOH溶液反应生成NaAlO2,并放出NH3,则化学方程式为![]() ;NH3物质的量
;NH3物质的量![]() ,则AlN物质的量为0.3mol,AlN质量分数为
,则AlN物质的量为0.3mol,AlN质量分数为![]() ,故答案为:
,故答案为:![]() ;61.5%;
;61.5%;
(2)反应后气体平均摩尔质量![]() ,根据反应
,根据反应![]() ;
;![]() ;
;![]() 可知反应后气体为CO和CO2的混合物,设反应后CO物质的量为xmol,CO2物质的量为ymol,由氧原子质量守恒可得①
可知反应后气体为CO和CO2的混合物,设反应后CO物质的量为xmol,CO2物质的量为ymol,由氧原子质量守恒可得①![]() ,反应后气体平均摩尔质量②
,反应后气体平均摩尔质量②![]() ,由①②解得x=0.14,y=0.02,则反应前C的质量
,由①②解得x=0.14,y=0.02,则反应前C的质量![]() ,故答案为:1.92。
,故答案为:1.92。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】茉莉醛被广泛应用于食品、化妆品和洗涤剂中。实验室制备茉莉醛的反应:![]() +CH3(CH2)5CHO
+CH3(CH2)5CHO![]()
![]() +H2O,有关数据如下表:
+H2O,有关数据如下表:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |
实验室制备茉莉醛的装置示意图如下:

实验步骤:
在a中加入5.30 mL苯甲醛、5 mL95%乙醇、12 mL10%KOH溶液,在c中加入6.84 g庚醛。搅拌并加热至60~65℃,打开c向a中缓慢滴加庚醛。保温搅拌反应3 h。反应待冷却后,静置分层,分出有机层,水层用20 mL二氯甲烷分两次萃取,萃取分液后与有机层合并,有机层再用10 mL水洗涤3次,洗涤后加入无水Na2SO4。蒸馏,收集287~290℃馏分,馏分用柱色谱法进行分离,得纯净的茉莉醛4.04g。已知:柱色谱分离中,先将液体样品从柱顶加入,流经吸附柱时,即被吸附在柱的上端,然后从柱顶加入洗脱剂,由于吸附剂对各组分吸附能力不同,各组分以不同速度沿柱下移,从而达到分离的效果。
回答下列问题:
(1)仪器a的名称是___________,实验中应采取的加热方法是___________。
(2)在洗涤操作中,用水洗涤的主要目的是________,加入无水Na2SO4的目的是________。
(3)用二氯甲烷萃取分液时,水层在_____(填“上”或“下”)层。
(4)柱色谱法分离中使用的吸附剂为硅胶或碳酸钙,除此之外,还可以使用_______(填序号)
①活性炭 ②氯化钠 ③氧化铝 ④碳酸钾
(5)柱色谱法分离过程中,如果洗脱剂加入速度太快,会使产品产率_______(填“偏高”、“不变”、“偏低”)
(6)本实验所得茉莉醛产率为______%。