题目内容
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:
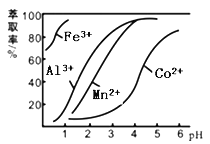
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。
【答案】(1)(4分)Fe3+、Co3+(2分)
SO32-+2Fe3++H2O=SO42-+ 2Fe2++2H+或SO32-+2 Co3++H2O=SO42-+ 2Co2++2H+(2分)
(2)(3分)ClO3-+6Fe2+ +6H+=6Fe3++Cl- +3H2O
(3)(3分)因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O![]() M(OH)3+3H+(1分),加入碳酸钠后CO32-与H+结合生成难电离的HCO3-(1分),使水解平衡右移而产生沉淀(1分)[或:CO32-可发生水解CO32-+H2O
M(OH)3+3H+(1分),加入碳酸钠后CO32-与H+结合生成难电离的HCO3-(1分),使水解平衡右移而产生沉淀(1分)[或:CO32-可发生水解CO32-+H2O![]() HCO3-+OH-,而因Fe3+和Al3+也发生水解:M3++H2O
HCO3-+OH-,而因Fe3+和Al3+也发生水解:M3++H2O![]() (OH)3+3H+,从而形成双水解使平衡右移,金属离子生成沉淀。其它正确叙述相应给分]
(OH)3+3H+,从而形成双水解使平衡右移,金属离子生成沉淀。其它正确叙述相应给分]
(4)(2分)除去Mn2+(1分) B(1分)[pH=3时,Co2+溶解最少,其它离子溶解较多]
(5)(2分)0.7[Ksp(MgF2)÷Ksp(CaF2)=7.35×10-11÷1.05×10-10=0.7]
【解析】试题分析:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴。
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,反应的离子方程式为SO32-+2Fe3++H2O=SO42-+ 2Fe2++2H+或SO32-+2 Co3++H2O
=SO42-+ 2Co2++2H+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2+ +6H+=6Fe3++Cl- +3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O![]() R(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀;
R(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)当加入过量NaF后,所得滤液中c(Mg2+) / c(Ca2+) =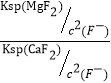 =
=![]() = 0.7。
= 0.7。