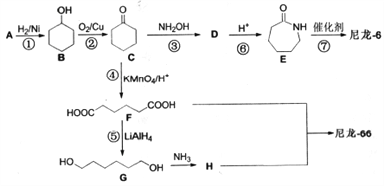
题目内容
【题目】锌-铈液流电池体系作为氧化还原液流电池中的新生一代,有着诸多的优势,如开路电位高、污染小等。锌-铈液流电池放电时的工作原理如图所示,其中,电极为惰性材料,不参与电极反应。下列有关说法正确的是
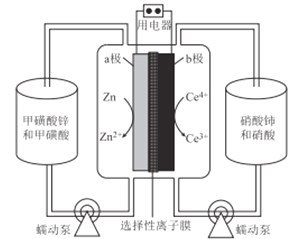
A. 放电时,电池的总反应式为2Ce4++Zn=Zn2++2Ce3+
B. 充电时,a极发生氧化反应,b极发生还原反应
C. 充电时,当电路中通过0.1mol电子时,b极增加14g
D. 选择性离子膜为阴离子交换膜,能阻止阳离子通过
【答案】A
【解析】A. 放电时,负极反应式为Zn-2e-= Zn2+,正极反应式为2Ce4+ +2e -=2Ce3+,故电池的总反应式为2Ce4++Zn=Zn2++2Ce3+,故A正确;B. 充电时,a极为阴极,发生含有反应,b极为阳极,发生氧化反应,故B错误;C. 充电时,当电路中通过0.1mol电子时,b极生成了0.1mol Ce4+,Ce4+不在b极上析出,故C错误;D.充电和放电过程中,正极电解液与负极电解液不能混合,加入的H+起平衡电荷的作用,故为质子交换膜,故D错误;故选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目