题目内容
【题目】已知 2Fe2+ +Br2 = 2Fe3+ + 2Br-;2 Br- + Cl2 = Br2 + 2Cl-;2Fe3+ + 2I-= 2Fe2+ + I2。向 FeI2、FeBr2 的 混合溶液中通入 Cl2,溶液中某些离子的物质的量 n(离子)随通入 Cl2 的物质的量 n(Cl2)变化如图所示。则下列有关说法中不正确的是( )
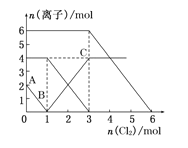
A. 还原性:I>Fe2+>Br
B. 原溶液中:n(Fe2+):n(I):n(Br)=2:1:3
C. 原混合溶液中 FeBr2 的物质的量为 6 mol
D. 当通入 2mol Cl2 时,溶液中已发生的离子反应可表示为:2Fe2++2I+2Cl2═2Fe3++I2+4Cl
【答案】C
【解析】
根据微粒的还原性大小比较、反应的先后顺序、溶液中微粒浓度的大小及图像内容等信息分析解答。
A.2Fe2+ +Br2 = 2Fe3+ + 2Br-中还原性Fe2+>Br=, 2 Br-+ Cl2 = Br2 + 2Cl-中的还原性Br->Cl-,2Fe3+ + 2I-= 2Fe2+ + I2中的还原性I->Fe2+,所以还原性大小顺序为:I>Fe2+>Br,故A正确;
B. 根据方程式中微粒间的关系可知:A—B点,氯气消耗1mol,即n(I-)=2mol,所以原混合溶液中FeI2的物质的量为1 mol;在BC段发生反应:2Fe2++Cl2===2Fe3++2Cl-;n(Cl2) = 2mol,所以n(Fe2+)=4mol,在C后发生反应:Cl2+2Br-===2Cl-+Br2 ,n(Cl2) = 3mol,所以n(Br-)=6mol,故n(Fe2+):n(I):n(Br)=4:2:6=2:1:3,故B正确;
C.由于溶液中的n(Br-)=6mol,所以原混合溶液中FeBr2的物质的量为3 mol,故C错误;
D.当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-,故D正确。
故选C。

【题目】工业合成氨以及含氮废水的处理一直是工业研究的热点。回答下列问题:
(1)已知:氢气的燃烧热为-285.8kJ/mol,17g氨气在纯氧中燃烧生成氮气和液态水的过程中放热382.6kJ,则工业合成氨的热化学方程式为_________________。
(2)500℃时,在容积固定的密闭容器中模拟工业合成氢N2+3H2![]() 2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
2NH3,下表为容器中部分物质浓度随时间的变化情况(其余浓度未给出)。
时间/min | c(N2)/mol/L | c(H2)/mol/L | c(NH3)/mol/L |
0 | 0.18 | 2.3 | 0 |
5 | 0.08 | ||
6 | 0.08 | ||
10 | 0.06 | 1.94 | 0.24 |
500℃时,该反应的化学平衡常数K=_______L2·mol-2;5min内,反应的平均速率v(H2)_____ mol·L-1·min-1;6min时,某一条件发生了改变,可能是_____(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.分离出NH3
(3)无机含氮废水主要含有铵氮(NH4+)和硝氮(NO3-)。可使用电化学氧化法处理铵氮废水,原理是溶液中的NH4+直接在电极上放电生成无毒物质,该过程阳极上的电极反应式为_______________。为研究电化学氧化法去除铵氮的影响因素,在实验室中以石墨作电极模拟对高浓度铵氮废水进行电化学氧化处理,得到如下3组图像:



通过分析上述图像可知,最适宜选用的条件是___________、以及初始pH为11的碱性溶液。实验中,铵氮去除率总是高于总氮去除率的原因是__________________。

