题目内容
14gCu、Ag合金与足量某浓度的硝酸反应,将放出的气体与1.12L O2(标况)混合,恰好能被水全部吸收生成硝酸,则合金中Cu的质量为
| A.1.6g | B.3.2g | C.6.4g | D.9.6g |
B
试题分析:设合金中铜和银的物质的量分别是x、y。根据题意可知,该过程发生的化学反应有:铜和硝酸反应、硝酸的还原产物和氧气的反应又生成硝酸。铜、银和硝酸反应时金属失去电子,硝酸根离子得到电子生成气体氮的氧化物,氮的氧化物和氧气、水反应生成硝酸时,氮的氧化物失去电子氧气得到电子,这说明实质上得失电子物质为氧气和金属。1.12L O2(标况)的物质的量是1.12L÷22.4L/mol=0.05mol,所以转移电子的物质的量为0.05mol×4=0.2mol。则根据电子得失守恒可知2x+y=0.2,根据质量守恒可知64x+108y=14,解得x=0.05mol、y=0.1mol,所以合金中铜的质量为0.05mol×64g/mol=3.2g,答案选B。

练习册系列答案
相关题目
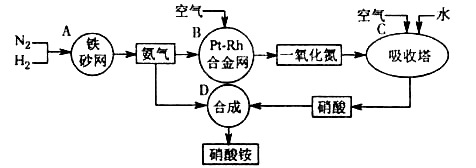
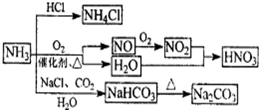
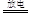 2NO
2NO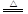 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O