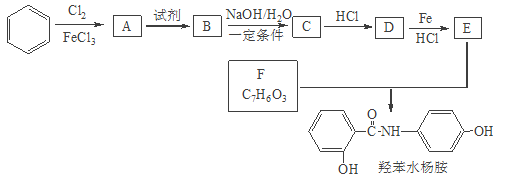
题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,____与盐酸反应的速度最慢;____与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为______________________________;
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________,________________;
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律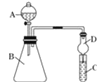
(4)干燥管D的作用为_______________;
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有______________溶液的洗气瓶.
【答案】钾 铝 铝 S2﹣+Cl2═S↓+2Cl﹣ 不合理 用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而NH3·H2O不是氮元素的最高价氧化物的水化物 防止倒吸 有白色沉淀生成 饱和NaHCO3
【解析】
I.(1). 金属性K>Na>Mg>Al,金属越活泼,与酸反应越剧烈,则将钠、钾、镁、铝各1mol分别投入到足量同浓度的盐酸中,钾与盐酸反应最剧烈,铝与盐酸反应的速度最慢,钠、钾、镁、铝均为1mol时Al失去电子最多,则铝与盐酸反应产生的气体最多,故答案为:钾;铝;铝;
(2). 向Na2S溶液中通入氯气出现黄色浑浊,说明生成单质S,证明Cl的非金属性比S强,该反应的离子方程式为:S2+Cl2=S↓+2Cl,故答案为:S2+Cl2=S↓+2Cl;
(3). 将NaOH溶液与NH4Cl溶液混合生成NH3H2O,可以说明NaOH的碱性大于NH3H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物对应水化物的碱性来进行比较,而NH3H2O不是氮元素的最高价氧化物的水化物,故答案为:不合理;用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而NH3H2O不是氮元素的最高价氧化物的水化物;
Ⅱ.(4). 球形干燥管D能够防止倒吸,避免C中液体进入锥形瓶中,故答案为:防止倒吸;
(5). 二氧化碳与硅酸钠溶液反应生成硅酸白色沉淀,因氯化氢具有挥发性,会干扰实验结果,需将二氧化碳中混有的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,故答案为:有白色沉淀生成;饱和NaHCO3。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案