题目内容
把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好
反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
| A.(l0b - 5a))mol/L | B.(2b-a)mol/L |
C.(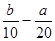 )mol/L )mol/L | D.(5b- )mol/L )mol/L |
A
解析试题分析:根据关系式NH4HCO3 ---2NaOH可得NH4HCO3的物质的量为0.5amol,0.5amolNH4HCO3消耗盐酸0.5amol,所以Na2CO3消耗盐酸的物质的量为b-0.5a,根据关系式:Na2CO3---2 HCl,可得Na+的物质的量为(b-0.5a)mol,每份体积为100 mL,c(Na+)=(l0b - 5a))mol/L,故A正确。
考点:考查化学方程式的有关计算、物质的量浓度的计算。

练习册系列答案
相关题目
用NA代表阿伏加德罗常数的数值,下列叙述正确的是
| A.在铁参与的反应中,5.6g铁完全反应失去的电子数一定为0.3NA |
| B.1mol 12C18O2中,所含的中子数为22NA |
| C.标准状况下,11.2 LCO和N2混合气体中含有的分子数是0.5NA |
| D.常温下,pH=12的1L氨水中含有的NH3·H2O分子数是0.01 NA |
只给出下列甲和乙中对应的量,不能求出物质的量的是( )
| | A | B | C | D |
| 甲 | 物质的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
| 乙 | 阿伏加德罗常数 | 标准状况下的气体体积 | 固体的密度 | 溶液的体积 |
向10 g Fe2O3、SiO2和Al2O3的混合物中,加入100 mL x mol/L稀硫酸,过滤后,向滤液中加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。下列叙述错误的是( )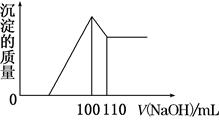
| A.混合物和稀硫酸反应时,稀硫酸过量 |
| B.可求出x的值 |
| C.可求出Al2O3的质量分数 |
| D.可求出Fe2O3的质量分数 |
下列说法正确的是
| A.2.24 L CO2中共有的原子数为0.3×6.02×1023 |
B.1.8 g N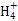 共有的质子数为6.02×1023 共有的质子数为6.02×1023 |
| C.1 mol重水分子所含中子数为10×6.02×1023 |
| D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023 |
下列有关化学用语表示正确的是( )
| A.下图中的①是N2的电子式 |
| B.下图中的②是S2-的结构示意图 |
C.质子数为53,中子数为78的碘原子: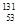 I I |
| D.下图③为CO2的结构式 |
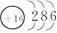 O—C—O
O—C—O① ② ③
若用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
| B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA |
| C.常温常压下,20 g D2O含有的原子总数为3NA |
| D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA |
下列化学用语使用不正确的是( )。
A.Na+的结构示意图为 |
| B.明矾的化学式为KAl(SO4)2·12H2O |
| C.聚乙烯的结构简式为CH2===CH2 |
| D.高氯酸(HClO4)中氯元素的化合价为+7 |
下列有关化学用语的表示正确的是( )
A.S2-的结构示意图为: |
| B.质子数为53、中子数为78的碘原子:13153I |
C.F-的结构示意图: |
| D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H2188O |