题目内容
 (2011?姜堰市二模)决定物质性质的重要因素是物质结构.请回答下列问题.
(2011?姜堰市二模)决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
>
>
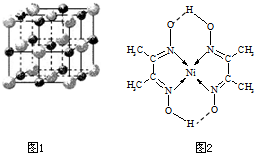
B的化合价(填“>”、“<”或“=”).(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
TiN>MgO>CaO>KCl
TiN>MgO>CaO>KCl
.(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
CrO2
CrO2
.(4)某配合物的分子结构如图2所示,则N原子的杂化方式为
sp2
sp2
;基态Ni原子的电子排布式[Ar]3d84s2
[Ar]3d84s2
.分析:(1)A和B为第三周期元素,由电离能数据可知A可失去3个电子,B可失去2个电子;
(2)离子晶体的晶格能越大,熔点越高;
(3)根据离子的最外层电子数判断;
(4)根据分子结构可知N形成2个δ键和1个配位键,根据能量最低原理书写电子排布式.
(2)离子晶体的晶格能越大,熔点越高;
(3)根据离子的最外层电子数判断;
(4)根据分子结构可知N形成2个δ键和1个配位键,根据能量最低原理书写电子排布式.
解答:解:(1)A和B为第三周期元素,由电离能数据可知A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则最高化合价A>B,故答案为:>;
(2)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>MgO,MgO>CaO,由表中数据可知CaO>KCl,则TiN>MgO>CaO>KCl,
故答案为:TiN>MgO>CaO>KCl;
(3)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,为成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2;
(4)根据分子结构可知N形成2个δ键和1个配位键,为杂化sp2,Ni的原子序数为28,电子排布式为[Ar]3d84s2,
故答案为:sp2;[Ar]3d84s2.
(2)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>MgO,MgO>CaO,由表中数据可知CaO>KCl,则TiN>MgO>CaO>KCl,
故答案为:TiN>MgO>CaO>KCl;
(3)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,为成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2;
(4)根据分子结构可知N形成2个δ键和1个配位键,为杂化sp2,Ni的原子序数为28,电子排布式为[Ar]3d84s2,
故答案为:sp2;[Ar]3d84s2.
点评:本题考查较为综合,涉及多个方面的知识,注意把握晶格能的比较以及电子排布式的书写方法.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目