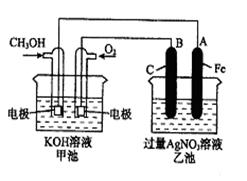
题目内容
(6分)(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是

(1)X>Y>Z
(2)2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
(3) ⑸⑵⑴⑶⑷
(2)2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
(3) ⑸⑵⑴⑶⑷
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。X、Y组成原电池,X是负极,因此X的金属性强于Y;Y放在Z的硝酸盐溶液中,Y表面有Z析出,则Y的金属性强于Z,所以金属性强弱顺序是X>Y>Z。
(2)氢气和氧气反应生成1mol水蒸气放热241.8 kJ,所以该反应的热化学方程式是)2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1。
(3)根据装置图可知,(1)装置是铁的化学腐蚀,(2)、(3)是原电池,其中(2)中铁是负极加速腐蚀,(3)中铁是正极,被保护;(4)、(5)是电解池,其中(4)中铁是阴极,被保护,(5)中铁是阳极,失去电子,加快腐蚀,所以铁片腐蚀由快到慢的顺序是⑸⑵⑴⑶⑷。
(2)氢气和氧气反应生成1mol水蒸气放热241.8 kJ,所以该反应的热化学方程式是)2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1。
(3)根据装置图可知,(1)装置是铁的化学腐蚀,(2)、(3)是原电池,其中(2)中铁是负极加速腐蚀,(3)中铁是正极,被保护;(4)、(5)是电解池,其中(4)中铁是阴极,被保护,(5)中铁是阳极,失去电子,加快腐蚀,所以铁片腐蚀由快到慢的顺序是⑸⑵⑴⑶⑷。

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目

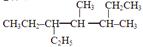 ,它的分子式是 ,名称是 。
,它的分子式是 ,名称是 。
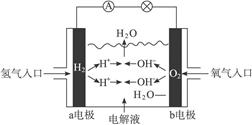

 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。