题目内容
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如下图所示,该电池放电时,右槽中的电极反应为:V2+ - e-? = V3+,下列说法正确的是

A.放电时,右槽发生还原反应
B.充电时,阴极电解液pH升高
C.充电时,每转移lmol电子,n(H+)的变化量为l mol
D.放电时,左槽的电极反应式:VO2++ 2H+ + e-? = VO2++ H2O
【答案】
D
【解析】
试题分析:原电池中,正极发生氧化反应,负极发生还原反应,根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理和电解池的工作原理进行分析;右槽是负极,发生氧化反应,A错误;左槽是正极,发生的电极反应式:VO2++ 2H+ + e- 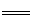 VO2++ H2O,D正确;负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电池反应为VO2++V2++2H+
VO2++ H2O,D正确;负极发生失电子的氧化反应,即反应为V2+-e-=V3+,电池反应为VO2++V2++2H+ VO2++V3++H2O,所以充电时阴极电极反应为V3++e-═V2+;阳极电极反应为 VO2++ H2O-e-
VO2++V3++H2O,所以充电时阴极电极反应为V3++e-═V2+;阳极电极反应为 VO2++ H2O-e- VO2++ 2H+ ,充电时,阳极电解液pH降低,B错误;充电时,每转移lmol电子,n(H+)的变化量为2mol,故C错误;故选D。
VO2++ 2H+ ,充电时,阳极电解液pH降低,B错误;充电时,每转移lmol电子,n(H+)的变化量为2mol,故C错误;故选D。
考点:考查原电池的工作原理。

练习册系列答案
相关题目
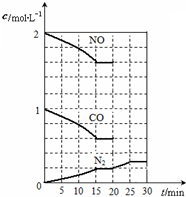
 VO2++ 2H++V2+。
VO2++ 2H++V2+。 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。

 VO2++
2H++V2+。
VO2++
2H++V2+。