题目内容
【题目】已知液氨的性质与水相似,25℃时,NH3+NH3NH ![]() +NH
+NH ![]() ,NH
,NH ![]() 的平衡浓度为1×10﹣15molL﹣1 , 则下列说法中正确的是( )
的平衡浓度为1×10﹣15molL﹣1 , 则下列说法中正确的是( )
A.在液氨中加入NaNH2可使液氨的离子积变大
B.在液氨中加入NH4Cl可使液氨的离子积减小
C.在此温度下液氨的离子积为1×10﹣17
D.在液氨中放入金属钠,可生成NaNH2
【答案】D
【解析】解:A、虽然加入NaNH2可使平衡向逆反应方向移动,NH2﹣的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故A错误;
B、虽然加入NH4Cl可使平衡向逆反应方向移动,NH4+的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故B错误;
C、由电离方程式知,NH4+与NH2﹣的离子平衡浓度相等都为1×10﹣15mol/L,根据水的离子积得液氨的离子积为
K=c(NH2﹣)c(NH4+)=1×10﹣30 , 故C错误;
D、由钠与水反应可推知,2Na+2NH3=2NaNH2+H2↑,故D正确;
故选D.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______________、_________________。
实验用品 | 溶液温度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | _______ |
② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ | |
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1·kg-1,各物质的密度均为lg·cm-3。计算完成上表。△H=____________
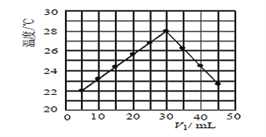
(3)某研究小组将V1mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2 =50mL)。此反应所用NaOH溶液的浓度应为__________mol/L。