题目内容
3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2,反应后溶液中含有amolH+,则此时溶液中含有NO3-的物质的量为( )A.(0.1+a)mol
B.(0.2+a)mol
C.(0.05+a)mol
D.amol
【答案】分析:铜与过量硝酸反应,反应后溶液中的溶质是硝酸和硝酸铜,根据硝酸中NO3-和H+、硝酸铜中NO3-和Cu2+的关系式,由H+、Cu2+的量计算NO3-的物质的量.
解答:解:3.2g的物质的量为:3.2g÷64g/mol=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1 2
0.05mol x
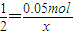 ,解得x=0.1mol,
,解得x=0.1mol,
HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a )mol
故选A.
点评:本题考查的是硝酸的性质及守恒法的运用,守恒有原子守恒、电荷守恒、质量守恒、得失电子守恒,在做题时要灵活运用,不能生搬硬套.
解答:解:3.2g的物质的量为:3.2g÷64g/mol=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1 2
0.05mol x
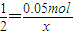 ,解得x=0.1mol,
,解得x=0.1mol,HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a )mol
故选A.
点评:本题考查的是硝酸的性质及守恒法的运用,守恒有原子守恒、电荷守恒、质量守恒、得失电子守恒,在做题时要灵活运用,不能生搬硬套.

练习册系列答案
相关题目
3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2,反应后溶液中含有amolH+,则此时溶液中含有NO3-的物质的量为( )
| A.(0.2+a)mol | B.(0.1+a)mol | C.(0.05+a)mol | D.amol |