题目内容
 科学家认为,氢气是一种高效而无污染的理想能源.为减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.
科学家认为,氢气是一种高效而无污染的理想能源.为减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:在101kPa下,2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1H2O(g)=H2O(l)△H=-44kJ?mol-1
(1)CO的标准燃烧热△H=
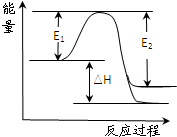
(2)如图为1molH2与足量O2反应生成液态水和气态水的能量变化关系图,则图中的△H=
(3)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
分析:(1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
(2)图中的△H表示1molH2与足量O2反应生成液态水的反应热由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、H2O(g)═H2O(l)△H=-44.0KJ/mol来计算;
(3)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式.
(2)图中的△H表示1molH2与足量O2反应生成液态水的反应热由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、H2O(g)═H2O(l)△H=-44.0KJ/mol来计算;
(3)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式.
解答:解:(1)2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1,则CO(g)+
O2(g)═CO2(g)△H=-283.0 kJ?mol-1,热化学方程式中CO的物质的量为1mol,生成稳定的氧化物二氧化碳,符合燃烧热的定义,△H等于CO的燃烧热,
故答案为:-283 kJ?mol-1;
(2)图中的△H表示1molH2与足量O2反应生成液态水的反应热,由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、2H2O(g)═2H2O(l)△H=-88.0KJ/mol,即2mol氢气燃烧生成液态水,放出的热量为483.6kJ+88kJ=571.6kJ,则1mol氢气燃烧生成液态水时放出的热量为
=285.8kJ,则图中的△H=-285.8 kJ?mol-1,
故答案为:-285.8 kJ?mol-1;
(3)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,
根据盖斯定律可知
得CO(g)+H2O(g)═CO2(g)+H2(g),
△H=
=-41.2kJ/mol,
即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ?mol-1.
| 1 |
| 2 |
故答案为:-283 kJ?mol-1;
(2)图中的△H表示1molH2与足量O2反应生成液态水的反应热,由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、2H2O(g)═2H2O(l)△H=-88.0KJ/mol,即2mol氢气燃烧生成液态水,放出的热量为483.6kJ+88kJ=571.6kJ,则1mol氢气燃烧生成液态水时放出的热量为
| 571.6kJ |
| 2 |
故答案为:-285.8 kJ?mol-1;
(3)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,
根据盖斯定律可知
| ①-② |
| 2 |
△H=
| -566kJ/mol-(-483.6kJ/mol) |
| 2 |
即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ?mol-1.
点评:本题主要考查了热化学反应方程式的计算,掌握盖斯定律的应用是解答的关键,题目难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目

 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1