题目内容
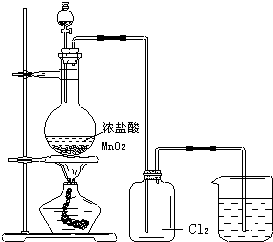 如图为“在实验室中制取氯气”的装置图:
如图为“在实验室中制取氯气”的装置图:(1)加热时要小心地、不停地移动火焰,以控制反应温度,要防止加强热,否则会
使浓盐酸里的氯化氢气体挥发出来,使制得的氯气不纯
使浓盐酸里的氯化氢气体挥发出来,使制得的氯气不纯
.(2)烧杯中盛放的溶液用来吸收多余的Cl2,反应的化学方程式为
2NaOH+Cl2=NaCl+NaClO+H2O
2NaOH+Cl2=NaCl+NaClO+H2O
.分析:(1)依据浓盐酸易挥发分析判断;
(2)多余的氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)多余的氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收;
解答:解:(1)加热时要小心地、不停地移动火焰,以控制反应温度,要防止加强热,避免浓盐酸里的氯化氢气体挥发出来,使制得的氯气不纯,
故答案为:使浓盐酸里的氯化氢气体挥发出来,使制得的氯气不纯;
(2)多余的氯气有毒不能排放到空气中,烧杯中盛放的氢氧化钠溶液用来吸收多余的Cl2,反应的化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
故答案为:使浓盐酸里的氯化氢气体挥发出来,使制得的氯气不纯;
(2)多余的氯气有毒不能排放到空气中,烧杯中盛放的氢氧化钠溶液用来吸收多余的Cl2,反应的化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
点评:本题考查实验室制备氯气的原理分析,尾气吸收,氯气性质是解题关键,题目较简单.

练习册系列答案
相关题目
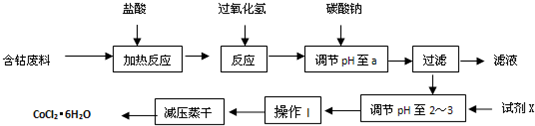
氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法。
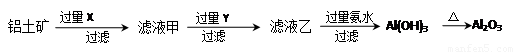
(1)氯化铝融盐电解法需要先制纯氧化铝。以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料通过以下途径提纯氧化铝:

 |
①依次写出X、Y的成分 , 。
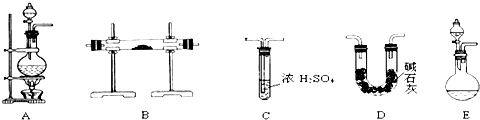
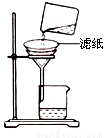
②如右图所示在实验室中进行过滤,
操作中的两处错误分别是 ;
。
(2)制备无水氯化铝的反应为:2Al2O3+6Cl2![]() 4AlCl3+3O2
4AlCl3+3O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是 。
④加入焦炭后的化学反应可表示为Al2O3+C+Cl2![]() AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
(3)现在工业上通常用电解熔融氧化铝方式制取铝,理论上生产1吨铝消耗的氧化铝的质量 (填“大于”、“小于”、“等于”)氯化铝质量。
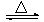 4AlCl3+3O2
4AlCl3+3O2
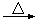 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由
。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由
。