题目内容
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。
(1)实验室最常用的制备氨气的化学方程式为______________________
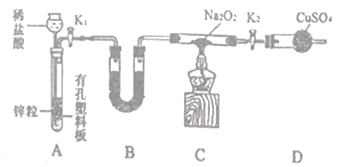
(2)欲用上述方法收集一瓶干燥的氨气,装置连接顺序为: __________________(按气流方向,用小写字母表示,包括发生装置和尾气处理)。
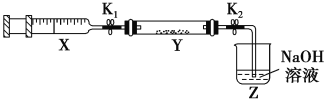
(3)硬质玻璃管Y中加入少量催化剂和NO2 ,将上述收集到的NH3充入注射器X中,打开K1,将X中气体推入Y,关闭K1。已知反应生成两种环保无污染的产物,请写出该过程的化学方程式:_____________________,Y中的现象是__________________________(K2始终保持闭合)
(4)标况下,25.6g铜粉与一定量硝酸恰好完全反应,收集到NO和NO2混合气体共8.96L,则NO和NO2的体积比为_____________ ,表现酸性的硝酸的物质的量为_________mol。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O adcfei 8NH3+6NO2
CaCl2+2NH3↑+2H2O adcfei 8NH3+6NO2![]() 7N2 +12H2O 红棕色气体颜色变浅,玻璃管内璧上有小水珠 1:1 0.8mol
7N2 +12H2O 红棕色气体颜色变浅,玻璃管内璧上有小水珠 1:1 0.8mol
【解析】
(1)实验室用NH4Cl和Ca(OH)2固体反应制氨气。
(2)实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,制备的气体中含有水蒸气,氨气为碱性气体,应选择盛有碱石灰干燥管干燥气体,氨气极易溶于水,密度小于空气密度所以应选择向下排空气法收集气体,氨气极易溶于水,尾气可以用水吸收,注意防止倒吸。
(3)打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应生成无色氮气。
(4)根据转移电子相等计算生成NO和NO2和物质的量,根据氮原子守恒计算表现酸性的硝酸的物质的量。
(1)实验室用NH4Cl和Ca(OH)2固体反应制氨气,化学方程式为:
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,制备的气体中含有水蒸气,氨气为碱性气体,应选择盛有碱石灰干燥管干燥气体,氨气极易溶于水,密度小于空气密度所以应选择向下排空气法收集气体,氨气极易溶于水,尾气可以用水吸收,注意防止倒吸,所以正确的连接顺序为 a→d→c→f→e→i,故答案为:adcfei 。
(3)打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应生成无色氮气,化学方程式为8NH3+6NO2![]() 7N2 +12H2O,看到现象为:红棕色气体慢慢变浅,玻璃管内璧上有小水珠;故答案为: 8NH3+6NO2
7N2 +12H2O,看到现象为:红棕色气体慢慢变浅,玻璃管内璧上有小水珠;故答案为: 8NH3+6NO2![]() 7N2 +12H2O;红棕色气体颜色变浅,玻璃管内璧上有小水珠。
7N2 +12H2O;红棕色气体颜色变浅,玻璃管内璧上有小水珠。
(4)25.6g铜粉的物质的量为0.4mol,标况下,8.96L混合气体的物质的量为0.4mol,设NO和NO2和物质的量为分别x,y,x+y=0.4mol,2×0.4mol= 3x+y,解得x=y=0.2mol,则NO和NO2的体积比为1:1,根据氮原子守恒知,表现酸性的硝酸的物质的量为n(HNO3)=2n[Cu(NO3)]= 0.4mol×2=0.8mol,故答案为:1:1 ;0.8mol。

【题目】下表为元素周期表的一部分,回答下列有关问题(填写化学符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑴ | ⑻ | ⑵ | |||||
三 | ⑶ | ⑷ | ⑸ | ⑹ | ⑺ | ⑼ | ||
四 | ⑽ | ⑾ | ⑿ |
(1)⑴-⑿元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是_____。
(2)元素⑼在周期表中的位置_______________,若⑻的一种核素中含有10个中子,用![]() 表示该原子:______________。
表示该原子:______________。
(3)在⑴-⑿元素中,原子半径最小的是______________,原子半径最大的是__________。
(4)第三周期简单阴离子半径最大的离子是____________