题目内容
【题目】反应2NO(g)+O2(g)=2NO2(g)由①、②两步反应构成,其反应进程与能量关系如图,所示。已知:
①NO+O2 =NO3(快反应);②NO3+NO=2NO2(慢反应)。下列说法正确的是
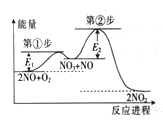
A. NO3比NO稳定
B. ①、②两步反应均为放热反应
C. 第②步的逆反应的活化能更大,因此NO2更容易转化为NO3和NO
D. 升高温度,①、②两步反应速率均加快
【答案】D
【解析】A、NO3能量高比NO稳定性差,故A错误;B、①为吸热反应、②反应为放热反应,故B错误;C、第②步的逆反应的活化能更大,因此NO2更难转化为NO3和NO,故C错误;D. 升高温度,能增加分子的内能,增加活化分子百分数,①、②两步反应速率均加快,故D正确;故选D。

练习册系列答案
相关题目
【题目】利用化肥生产中的废催化剂(主要成分为Al2O3、K2O、少量的CoO、SiO2等)来制取明矾的工艺流程如图所示。
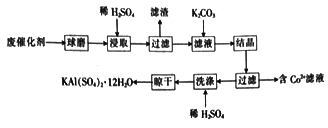
(1)KAl(SO4)2 12H2O中A1的化合价为__________。
(2)废催化剂在浸取前进行球磨的主要目的是______________。
(3)浸取时Al2O3溶解的化学方程式为_________;滤渣的主要成分是______________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2 12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/% | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是__________________。