题目内容
工业上金属铝的生产是以Al2O3为原料,在熔融状态下进行电解流程如下:2Al2O 3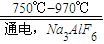 4Al+3O2
4Al+3O2注:冰晶石的作用是使E在较低温度下熔化.
请回答下列问题:
(1)冰品石(Na3AlF6)的作用是______..
(2)铝的最外层电子数______,在周期表中的位置是______.
(3)电解生成的金属铝是在熔融液的______(填“上层”或“下层”).阴极和阳极均由______材料做成;电解时所消耗的电极是______(填“阳极”或“阴极”).
(4)在标准状况下产生67.2L氧气,可得到金属铝______克.
【答案】分析:(1)Al2O3的熔点很高,加冰晶石降低Al2O3的熔点;
(2)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,以此可确定在周期表中的位置;
(3)电解的阴极、阳极材料均由石墨材料做,因阳极上O2-失电子发生氧化反应生成O2,阳极材料与该极上生成的O2反应被消耗;
(4)n(O2)= =3mol,结合电解方程式计算.
=3mol,结合电解方程式计算.
解答:解:(1)Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温度,
故答案为:降低Al2O3的熔化温度;
(2)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表中第三周期、ⅢA族,
故答案为:3;第三周期、ⅢA族;
(3)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层,电解时用惰性电极为电极材料,可用碳素(或石墨),电解时阳极的碳棒被生成的氧气氧化,故答案为:下层;碳素(或石墨); 阳极;
(4)n(O2)=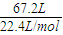 =3mol,电解方程式为2Al2O 3
=3mol,电解方程式为2Al2O 3 4Al+3O2,
4Al+3O2,
根据方程式可知生成3molO2,则生成4molAl,质量为4mol×27g/mol=108g,故答案为:108.
点评:本题考查金属的冶炼以及电解等知识,题目难度不大,本题注意把握金属的冶炼原理以及工业应用.
(2)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,以此可确定在周期表中的位置;
(3)电解的阴极、阳极材料均由石墨材料做,因阳极上O2-失电子发生氧化反应生成O2,阳极材料与该极上生成的O2反应被消耗;
(4)n(O2)=
 =3mol,结合电解方程式计算.
=3mol,结合电解方程式计算.解答:解:(1)Al2O3的熔点很高,熔化得需要较多能量,加入助熔剂就可节约能量,降低熔化温度,
故答案为:降低Al2O3的熔化温度;
(2)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表中第三周期、ⅢA族,
故答案为:3;第三周期、ⅢA族;
(3)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的小,所以铝在熔融液的下层,电解时用惰性电极为电极材料,可用碳素(或石墨),电解时阳极的碳棒被生成的氧气氧化,故答案为:下层;碳素(或石墨); 阳极;
(4)n(O2)=
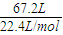 =3mol,电解方程式为2Al2O 3
=3mol,电解方程式为2Al2O 3 4Al+3O2,
4Al+3O2,根据方程式可知生成3molO2,则生成4molAl,质量为4mol×27g/mol=108g,故答案为:108.
点评:本题考查金属的冶炼以及电解等知识,题目难度不大,本题注意把握金属的冶炼原理以及工业应用.

练习册系列答案
相关题目