题目内容
(12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:
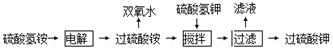
(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式
②写出水解器中(NH4)2S2O8溶液的水解方程式 。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
④试分析水解器中使用减压水解、蒸馏的原因 。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
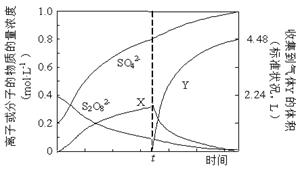
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为 。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式 .
(1)①2NH4HSO4 (NH4)2S2O8+H2(2分)
(NH4)2S2O8+H2(2分)
②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2(2分
③铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅(2分)
④减压水解、蒸馏是为了减少双氧水的分解损失。(2分)
(2)①H2O2 (2分)
②2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+(2分)
2MnO4-+10SO42-+16H+(2分)
【解析】
试题分析:(1)电解和水解的反应式均可根据题中所给反应物和生成物书写,可得①2NH4HSO4 (NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2
,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2
的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O
(NH4)2S2O8+H2,②(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2。③使用铂的原因是,铅会在阳极失电子生成阳离子进入溶液,且在阳极生成的S2O82-会氧化铅。④减压水解、蒸馏是为了减少双氧水的分解损失。(2)①刚开始,S2O82-发生反应,产生H2O2
,而H2O2 易分解,滴入少量FeCl3溶液,即是滴入了催化剂,加快了H2O2
的分解,故在t时含量迅速降低。故物质X就是H2O2 。②得到紫红色溶液,即有高锰酸根生成,故反应离子式为2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
考点:工艺流程
点评:本题属于常规工艺流程题,需要利用化学反应原理对生产工艺进行分析,其中涉及的化学原理都是常见化学物质的性质,接下来的小题会涉及不同的知识点来解答,要利用到物质的特殊化学性质,学生应当对这部分知识熟练掌握,最后的图像题,还是将图像信息转化为化学的文字信息来理解。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案


 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:______________________;
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:______________________; 。苯甲酸的同分异构体中,含苯环且属于酯类的结构简式为___________,属于酚类结构的同分异构体有___________种。
。苯甲酸的同分异构体中,含苯环且属于酯类的结构简式为___________,属于酚类结构的同分异构体有___________种。