题目内容
【题目】下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
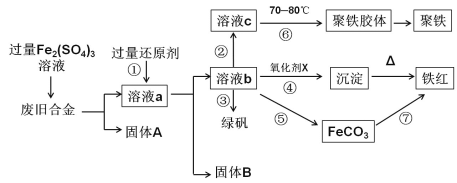
(1)加入过量Fe2(SO4)3溶液过程中与较活泼的金属反应的离子方程式: 。
(2)①中过量的还原剂应是 ,固体B是 。
(3)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
(4)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70~80 ℃的目的是 。
(5)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有 。
(6)在④中的氧化剂X是 。
(7)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出其离子反应方程式: 。
(8)在⑦中,写出FeCO3煅烧的化学反应方程式: 。
【答案】(1)2Fe3++Fe=3Fe2+
(2)铁粉(Fe)(1分)。铁粉、铜粉(Fe、Cu)。
(3)MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(4)升高温度促进Fe3+的水解,过高温度不利于聚铁的形成(或者完全水解了)
(5)蒸发皿、玻璃棒
(6)Na2O2或NaClO(或其它合理答案)
(7)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
(8)FeCO3+O2![]() 2Fe2O3+4CO2↑
2Fe2O3+4CO2↑
【解析】
试题分析:(1)加入过量Fe2(SO4)3溶液能与Fe和Cu反应,铁较活泼,反应的离子方程式2Fe3+ + Fe = 3Fe2+;(2)根据流程,a含有Fe2+、Fe3+、Cu2+,加入还原剂后,a溶液中只含有Fe2+,所以①中过量的还原剂应是铁,固体B是铜;(3) 向溶液b中含有Fe2+,加入酸性KMnO4溶液发生反应的离子方程式为MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O;(4)向溶液b中含有Fe2+,中加入H2O2,把Fe2+氧化为Fe3+,Fe3+易水解在⑥中,将溶液c控制到70~80 ℃的目的是升高温度促进Fe3+的水解 ,过高温度不利于聚铁的形成;(5)蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有蒸发皿 、玻璃棒;(6)根据流程图,在④中的氧化剂X是Na2O2;(7)向溶液硫酸亚铁溶液中加入了NH4HCO3溶液,得到FeCO3沉淀,其离子反应方程式Fe2+ + 2HCO3- = FeCO3↓ + CO2↑+ H2O;(8)FeCO3煅烧生成氧化铁,化学反应方程式FeCO3+O2![]() 2Fe2O3+4CO2↑。
2Fe2O3+4CO2↑。