题目内容
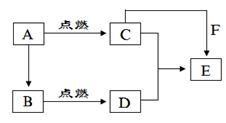
右图中,A为空气中常见的气体单质、B、C、E是金属单质,D为非金属单质。已知:①I是一种常见的温室气体,E原子核内有12个质子②G为红色物质,反应 能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:

(1)分别写出F、G、H、I的化学式
F G H I
(2)书写下列化学方程式
 ;
;
(3)C与NaOH溶液反应的化学方程式为 ,
反应后溶液与过量化合物I反应的化学方程式为 ;
⑷1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量为:
 能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
能放出大量的热,该反应曾应用于铁轨的焊接;回答下列问题:
(1)分别写出F、G、H、I的化学式
F G H I
(2)书写下列化学方程式
 ;
;
(3)C与NaOH溶液反应的化学方程式为 ,
反应后溶液与过量化合物I反应的化学方程式为 ;
⑷1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量为:
⑴ MgO Fe2O3 Al2O3 CO2
⑵2Al+ Fe2O3 2Fe+ Al2O3 2Mg+ CO2
2Fe+ Al2O3 2Mg+ CO2 2MgO + C
2MgO + C
⑶ 2Al + 2NaOH+ 2H2O = 2NaAlO2+ 3H2↑
NaAlO2+ CO2 + 2H2O = Al(OH)3↓+ NaHCO3
⑷ m(Cu)= 0.64 g
⑵2Al+ Fe2O3
 2Fe+ Al2O3 2Mg+ CO2
2Fe+ Al2O3 2Mg+ CO2 2MgO + C
2MgO + C ⑶ 2Al + 2NaOH+ 2H2O = 2NaAlO2+ 3H2↑
NaAlO2+ CO2 + 2H2O = Al(OH)3↓+ NaHCO3
⑷ m(Cu)= 0.64 g
试题分析:I为二氧化碳,则A为氧气、D为炭;E为Mg,C与G生成B和H的反应为铝热反应,C为Al,G为氧化铁,B为铁、H为氧化铝。(3)铝与氢氧化钠溶液生成偏铝酸钠和氢气;过量二氧化碳通入偏铝酸钠溶液生成氢氧化铝和碳酸氢钠。(4)n(Fe2O3)=0.01 mol。
Fe2O3 + 6HCl = 2FeCl3 + 3H2O 2FeCl3 + Cu =2FeCl2+ CuCl2
0.01mol 0.02 mol 0.02mol 0.01 mol
m(Cu)=0.64 g。
点评:铝热反应放出大量的热,可用于焊接钢轨和冶炼高熔点金属;氧化性Fe3+>Cu2+,所以氯化铁溶液能溶解铜。

练习册系列答案
相关题目