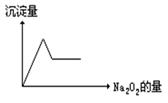
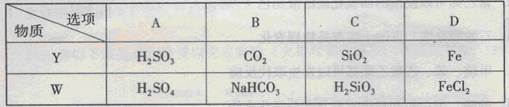
题目内容
(10分)
(1) 已知下列变化过程中,0.2 mol RxO42—参加反应时,共转移0.4 mol电子.
RxO+MnO4—+H+―→RO2+Mn2++H2O
①x值为________.
②参加反应的H+的物质的量为________mol.
(2) 在100 mL 0.100 mol/L的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2________升.
(3)要使含a mol Al3+的A溶液中铝元素和含有b mol AlO2—的B溶液中铝元素全部转化为Al(OH)3沉淀,有________种途径,Al(OH)3的物质的量为________.(不准加固体试剂和液体试剂)
(1) 已知下列变化过程中,0.2 mol RxO42—参加反应时,共转移0.4 mol电子.
RxO+MnO4—+H+―→RO2+Mn2++H2O
①x值为________.
②参加反应的H+的物质的量为________mol.
(2) 在100 mL 0.100 mol/L的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2________升.
(3)要使含a mol Al3+的A溶液中铝元素和含有b mol AlO2—的B溶液中铝元素全部转化为Al(OH)3沉淀,有________种途径,Al(OH)3的物质的量为________.(不准加固体试剂和液体试剂)
(1)①2 ②0.64 (2)0.336 (3)3 (a+b) mol
(1)①0.2 mol RxO42—参加反应时,共转移0.4 mol电子,所以反应中转移2mol电子。根据方程式可知,反应后R的化合价是+4价,反应前R的化合价是6/x,所以(4-6/x)×x=2,解得x=2。
②根据电子的得失守恒可知,方程式为5R2O42—+2MnO4—+16H+ 10RO2+2Mn2++8H2O,所以消耗的氢离子是16/5×0.2mol=0.64mol。
10RO2+2Mn2++8H2O,所以消耗的氢离子是16/5×0.2mol=0.64mol。
(2)由于亚铁离子和溴离子都能被氧化,则可以失去0.100molL×0.1L×3=0.03mol,所以根据电子的得失守恒可知,需要氯气是0.015mol,标准状况下的体积是0.336L。
(3) Al3+要转化为氢氧化铝,可以通入氨气;AlO2—要转化为氢氧化铝,可以通入CO2;或者将A和B混合,发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓。根据原子守恒可知,氢氧化铝的物质的量是(a+b)mol。
②根据电子的得失守恒可知,方程式为5R2O42—+2MnO4—+16H+
 10RO2+2Mn2++8H2O,所以消耗的氢离子是16/5×0.2mol=0.64mol。
10RO2+2Mn2++8H2O,所以消耗的氢离子是16/5×0.2mol=0.64mol。(2)由于亚铁离子和溴离子都能被氧化,则可以失去0.100molL×0.1L×3=0.03mol,所以根据电子的得失守恒可知,需要氯气是0.015mol,标准状况下的体积是0.336L。
(3) Al3+要转化为氢氧化铝,可以通入氨气;AlO2—要转化为氢氧化铝,可以通入CO2;或者将A和B混合,发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓。根据原子守恒可知,氢氧化铝的物质的量是(a+b)mol。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目