题目内容
11.现有含Na2SO4和Na2CO3的溶液100mL.取出50mL并向其中加入足量的BaCl2溶液,经过滤、洗涤、烘干后称重.沉淀的质量为4.3g,再将沉淀溶于足量的盐酸中,可产生标准状况下的气体0.224L.求:(1)原溶液中,Na2SO4和Na2CO3的物质的量分别是多少?
(2)原溶液中Na2SO4和Na2CO3的物质的量浓度分别是多少?
分析 发生反应有:Na2SO4+BaCl2=BaSO4↓+2NaCl、Na2CO3+BaCl2=BaCO3↓+2NaCl、BaCO3+2HCl=CO2↑+BaCl2+H2O,4.3g沉淀为硫酸钡和碳酸钡的混合物,生成的气体为二氧化碳,根据C元素守恒可计算出碳酸钡的物质的量,根据沉淀的总重量可计算出硫酸钡的质量、物质的量,从而可计算出原混合液中硫酸钠、碳酸钠的质量、物质的量浓度.
解答 解:(1)设50mL混合溶液中含有xmolNa2SO4、ymolNa2CO3,
Na2SO4+BaCl2=BaSO4↓+2NaCl
1 1
x x
Na2CO3+BaCl2=BaCO3↓+2NaCl
1 1
y y
则有:233x+197y=4.3,
生成二氧化碳的物质的量为:n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,
BaCO3+2HCl=CO2↑+BaCl2+H2O
1 1
ymol 0.01mol
y=0.01,
原100mL溶液中含有碳酸钠的物质的量为:0.01mol×2=0.02,mol;
根据①可得:x=$\frac{4.3g-197×0.01}{233}$=0.01,
则原100mL溶液中含有硫酸钠的物质的量为0.01mol,
答:原溶液中,Na2SO4和Na2CO3的物质的量都是0.02mol;
(2)原溶液中c(Na2SO4)=$\frac{0.02mol}{0.1L}$=0.2mol/L,c(Na2CO3)=$\frac{0.02mol}{0.1L}$=0.2mol/L,
答:原混和溶液中Na2SO4的物质的量浓度为0.2mol/L,Na2CO3的物质的量浓度为0.2mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | HCl气体通入硝酸银溶液中 | B. | 碳酸钙固体和稀盐酸制取CO2气体 | ||
| C. | 铁粉和氧气发生反应 | D. | 氯酸钾受热分解制氧气 |
| A. | Fe3O4根据化合价规律可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 | |
| B. | Fe与稀硝酸、稀硫酸反应均有气泡冒出,说明Fe与两种酸均发生了置换反应 | |
| C. | Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3 | |
| D. | CO2通入BaCl2溶液不产生沉淀,则CO2通入Ba(NO3)2溶液也不产生沉淀 |
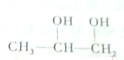 ,下列关于丙二醇的说法正确的是( )
,下列关于丙二醇的说法正确的是( )| A. | 丙二醇可发生消去反应生成丙炔 | |
| B. | 丙二醇可由丙烯在一定条件下与水加成制得 | |
| C. | 丙烯与溴水加成后,再与NaOH醇溶液共热水解可得丙二醇 | |
| D. | 丙二醇在铜存在下催化氧化可得到丙二醛 |
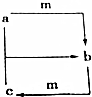 下列各组物质之间通过一步反应不能实现如图所示转化的是( )
下列各组物质之间通过一步反应不能实现如图所示转化的是( ) | 选项 | a | b | c | m |
| A | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 | 二氧化碳 |
| B | 硝酸 | 硝酸铁 | 硝酸亚铁 | 铁 |
| C | 硫酸铝 | 氢氧化铝 | 偏铝酸钠 | 氢氧化钠 |
| D | 氮气 | 一氧化氮 | 二氧化氮 | 氧气 |
| A. | A | B. | B | C. | C | D. | D |
 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有: