题目内容
某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀.查阅资料得知常温下BaSO3的KSP为5.48×10-7,饱和亚硫酸中c(SO
)=6.3×10-8mol-1.
(1)将0.1mol?L-1的BaCl2溶液滴入饱和亚硫酸中, (填“能”或“不能”)生成BaSO3沉淀,原因是 (请写出必要的推断过程).
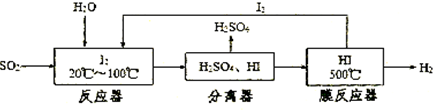
(2)浓硫酸的沸点为338℃,酒精灯火焰的温度为400-500℃,甲同学用装置Ⅰ进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸.
①写出加热试管中发生反应的化学方程式:
②白色沉淀的化学式是 ,请用离子方程式表示生成该白色沉淀的可能原因
(3)乙同学认为甲同学的装置不完善,设计了改进装置Ⅱ进行实验(夹持装置和A中加热装置已略,气密性已检验).
①打开弹簧夹,通入N2一段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成.操作①的目的是 ,洗气瓶B中的试剂是 .
(4)丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是 .
A.NaOH 溶液 B.Na[Al(OH)4]溶液 C.H2O2 溶液 D.酸性 KMnO4 溶液.
2- 3 |
(1)将0.1mol?L-1的BaCl2溶液滴入饱和亚硫酸中,
(2)浓硫酸的沸点为338℃,酒精灯火焰的温度为400-500℃,甲同学用装置Ⅰ进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸.
①写出加热试管中发生反应的化学方程式:
②白色沉淀的化学式是
(3)乙同学认为甲同学的装置不完善,设计了改进装置Ⅱ进行实验(夹持装置和A中加热装置已略,气密性已检验).

①打开弹簧夹,通入N2一段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成.操作①的目的是
(4)丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是
A.NaOH 溶液 B.Na[Al(OH)4]溶液 C.H2O2 溶液 D.酸性 KMnO4 溶液.
分析:(1)根据溶液中Q与Ksp的关系分析;
(2)①加热试管中发生反应是Cu与H2SO4(浓)反应生成硫酸铜和二氧化硫;
②根据硫酸的沸点和加热温度分析,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,由于BaSO3能够溶于盐酸,根据元素守恒可知该沉淀只能是BaSO4,有可能一是挥发出的H2SO4提供的SO42-与Ba2+反应生成的,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4;
(3)氮气性质稳定,排净装置中的空气中的氧气,以验证上述原理是否正确;为除去反应中带出的雾状硫酸,可以将气体通过NaHSO3溶液;
(4)乙实验后的C中的溶液会溶有SO2,题中不溶于盐酸的白色沉淀应是BaSO4,滴加一种无色溶液的氧化剂,只能是H2O2溶液,新制氯水是黄绿色,酸性KmnO4溶液是紫色.
(2)①加热试管中发生反应是Cu与H2SO4(浓)反应生成硫酸铜和二氧化硫;
②根据硫酸的沸点和加热温度分析,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,由于BaSO3能够溶于盐酸,根据元素守恒可知该沉淀只能是BaSO4,有可能一是挥发出的H2SO4提供的SO42-与Ba2+反应生成的,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4;
(3)氮气性质稳定,排净装置中的空气中的氧气,以验证上述原理是否正确;为除去反应中带出的雾状硫酸,可以将气体通过NaHSO3溶液;
(4)乙实验后的C中的溶液会溶有SO2,题中不溶于盐酸的白色沉淀应是BaSO4,滴加一种无色溶液的氧化剂,只能是H2O2溶液,新制氯水是黄绿色,酸性KmnO4溶液是紫色.
解答:解:(1)0.1mol?L-1的BaCl2溶液滴入饱和亚硫酸中没有沉淀生成,此时溶液中c(Ba2+)<0.1 mol?L-1,c(SO32-)<6.3×10-8mol?L-1,
其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7;
故答案为:不能;此时溶液中c(Ba2+)<0.1 mol?L-1,c(SO32-)<6,3×10-8mol?L-1,其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7;
(2)①加热试管中发生反应是Cu与H2SO4(浓)反应生成硫酸铜和二氧化硫,其反应方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
②本小题首先抓住已知信息“浓硫酸的沸点为338℃,加热时酒精灯火焰的温度为400℃~500℃”,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,由于BaSO3能够溶于盐酸,根据元素守恒可知该沉淀只能是BaSO4,有可能一是挥发出的H2SO4提供的SO42-与Ba2+反应生成BaSO4:SO42-+Ba2+═BaSO4↓,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+,故答案为:BaSO4;SO42-+Ba2+═BaSO4↓、2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;
(3)操作a通入N2目的是排出装置中的O2,C中未见沉淀生成,说明B中的试剂能吸收挥发出的H2SO4且不产生新的杂质,还不能与SO2反应,故该试剂应是饱和NaHSO3溶液,
故答案为:排除装置内的空气(O2);饱和NaHSO3溶液;
(4)乙实验后的C中的溶液会溶有SO2,题中不溶于盐酸的白色沉淀应是BaSO4,滴加一种无色氧化剂,只能是H2O2溶液,新制氯水是黄绿色,酸性KmnO4溶液是紫色,
故选:C.
其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7;
故答案为:不能;此时溶液中c(Ba2+)<0.1 mol?L-1,c(SO32-)<6,3×10-8mol?L-1,其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7;
(2)①加热试管中发生反应是Cu与H2SO4(浓)反应生成硫酸铜和二氧化硫,其反应方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
②本小题首先抓住已知信息“浓硫酸的沸点为338℃,加热时酒精灯火焰的温度为400℃~500℃”,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,由于BaSO3能够溶于盐酸,根据元素守恒可知该沉淀只能是BaSO4,有可能一是挥发出的H2SO4提供的SO42-与Ba2+反应生成BaSO4:SO42-+Ba2+═BaSO4↓,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+,故答案为:BaSO4;SO42-+Ba2+═BaSO4↓、2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;
(3)操作a通入N2目的是排出装置中的O2,C中未见沉淀生成,说明B中的试剂能吸收挥发出的H2SO4且不产生新的杂质,还不能与SO2反应,故该试剂应是饱和NaHSO3溶液,
故答案为:排除装置内的空气(O2);饱和NaHSO3溶液;
(4)乙实验后的C中的溶液会溶有SO2,题中不溶于盐酸的白色沉淀应是BaSO4,滴加一种无色氧化剂,只能是H2O2溶液,新制氯水是黄绿色,酸性KmnO4溶液是紫色,
故选:C.
点评:本题是以研究SO2的性质为载体的实验题,涉及Ksp的应用,方程式的书写,氧化剂的选择等,培养了学生灵活运用知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验室常用强氧化剂(如KMnO4、KClO3和MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸反应制备并检验氯气.供选用的实验试剂:a.Na2O2、b.浓盐酸、c.碱石灰、d.NaOH溶液、e.淀粉-KI溶液、f.CaCO3、g.石蕊试液、h.饱和NaCl溶液,装置如图所示(部分导管、蒸馏水略):
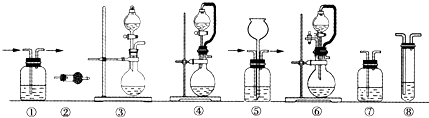
(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式: .
(2)下列装置组合最合理的是 (填序号,需考虑实验结束后拆卸装置时残留有害气体的处理).
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为 .
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:① ,② .
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一? (填“是”、“否”),理由是 .

(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式:
(2)下列装置组合最合理的是
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③ | ① | ⑧/e | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/e | ① |
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:①
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气.某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气.供选用的实验试剂及装置如下(部分导管、蒸馏水略):
a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液
f、CaCO3g、石蕊试液 h、饱和NaCl溶液
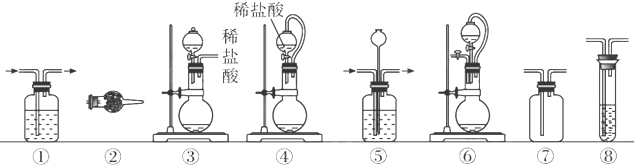
(1)写出实验室用二氧化锰和浓盐酸反应制备氯气的离子方程式
(2)写出用Na2O2与浓盐酸制备氯气的化学方程式 .该反应中盐酸的作用是
(3)下列装置组合最合理的是 (填序号,需考虑实验结束撤除装置时残留有害气体的处理).
(4)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为: .
(5)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
① ,
② .
a、Na2O2 b、浓盐酸 c、碱石灰 d、NaOH溶液 e、淀粉-KI溶液
f、CaCO3g、石蕊试液 h、饱和NaCl溶液

(1)写出实验室用二氧化锰和浓盐酸反应制备氯气的离子方程式
(2)写出用Na2O2与浓盐酸制备氯气的化学方程式
(3)下列装置组合最合理的是
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(5)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①
②
 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验