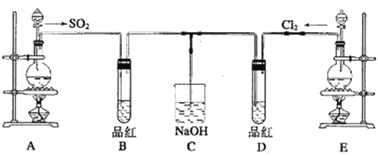
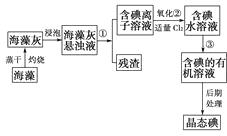
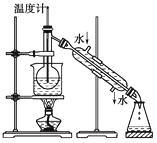
题目内容
【题目】一定条件下,某容积为1L的密闭容器中发生如下反应:C(s)+H2O(g)CO(g)+H2(g)
(1)维持温度不变,向该容器中充入2mol C(s)和2molH2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为
(2)在(1)中若起始时充入的是2.5molCO(g)和4mol H2(g),达到平衡后混合气体的平均相对分子质量为 .
【答案】
(1)15<M<18
(2)12
【解析】解:(1)反应前平均相对分子质量即为水蒸气的相对分子质量为18,假设C和水完全转化为CO和氢气,则生成2molCO和 2mol氢气,M= ![]() =
= ![]() =15g/mol,所以平均相对分子质量为15,故答案为:15<M<18;(2)
=15g/mol,所以平均相对分子质量为15,故答案为:15<M<18;(2) ![]() =
= ![]() =
= ![]() =12,故答案为:12. (1)利用极端假设法解答,反应前平均相对分子质量即为水蒸气的相对分子质量,假设C和水完全转化为CO和氢气,计算平均相对分子质量,据此解答;(2)2.5mol CO(g)和4mol H2 (g)的平均相对分子质量为12,假设生成xmolC,则气体质量减少2.5mol×28g/mol+4mol×2g/mol﹣12xg=78g﹣12xg,气体物质的量减少,2.5mol+4mol﹣xmol,据此计算平均相对分子质量.
=12,故答案为:12. (1)利用极端假设法解答,反应前平均相对分子质量即为水蒸气的相对分子质量,假设C和水完全转化为CO和氢气,计算平均相对分子质量,据此解答;(2)2.5mol CO(g)和4mol H2 (g)的平均相对分子质量为12,假设生成xmolC,则气体质量减少2.5mol×28g/mol+4mol×2g/mol﹣12xg=78g﹣12xg,气体物质的量减少,2.5mol+4mol﹣xmol,据此计算平均相对分子质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目