题目内容
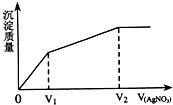 往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中c(Br-)/c(Cl-)的比值约为( )
往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中c(Br-)/c(Cl-)的比值约为( )| A、(V2-V1)/V1 | B、V1/V2 | C、V1/(V2-V1) | D、V2/V1 |
分析:根据沉淀溶解平衡常数:Ksp越小的越先形成沉淀,根据离子反应实质和图中数据来计算回答即可.
解答:解:因为Br-+Ag+=AgI↓,Cl-+Ag+=AgCl↓,可以看出Br-、Cl-跟Ag+反应都是1:1的关系,硝酸银先是和溴离子形成沉淀,然后和氯离子形成沉淀,由图中可知:将溴离子沉淀需要AgNO3的体积为V1(淡黄色沉淀是AgBr),而将氯离子沉淀需要AgNO3的体积为V2-V1,所以c(Br-):c(Cl-)=
.
故选C.
| V1 |
| V2-V1 |
故选C.
点评:本题考查学生难溶电解质的溶解平衡以及沉淀转化的知识,可以根据教材知识来回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 1L某混合溶液.可能含有的离子如下表: 1L某混合溶液.可能含有的离子如下表:
|
 1L某混合溶液.可能含有的离子如下表:
1L某混合溶液.可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
- A.该溶液中确定含有的离子有:H+、NH4+、Al3+
- B.肯定不存在的阴离子有:I-、ClO-、AlO2-
- C.不能确定是否含有的阳离子有:K+
- D.溶液中含有的Al3+和NH4+的物质的量之比为1:2
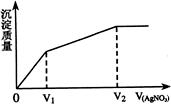 往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质 量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Br-)/c(Cl-)的比值约为
往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质 量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Br-)/c(Cl-)的比值约为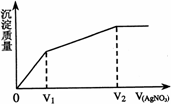 往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Br-)/c(Cl-)的比值约为
往含Br-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Br-)/c(Cl-)的比值约为