题目内容
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。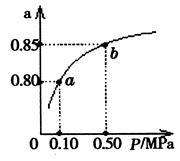
(共10分)(1)bc (2分)(2)Q1=4Q2 (2分)(3)3200 (2分)
(4)放(1分) 减小 (1分) (5)= (2分)
解析试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。速率之比是相应的化学计量数之比,因此a中的关系始终是成立,不正确;该反应是体积减小的可逆反应,因此压强也是减小的,所以当压强不再发生变化时,可以说明达到平衡状态,b正确;c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,d不正确,答案选bc。
(2)根据反应式可知,0.050 mol C就相当于是0.050 mol A和0.025mol B,由于温度和容积不变,所以平衡是等效的,即平衡时消耗C的物质的量是0.01mol,所以Q1与Q2之间的关系式可表示为Q1=4Q2。
(3)该温度下平衡时,A、B、C的浓度分别是0.01mol/L、0.005mol/L、0.04mol/L,所以平衡常数K=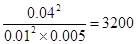 。
。
(4)已知:K(300℃)>K(350℃),这说明升高温度平衡常数减小,即升高温度平衡向逆反应方向进行,所以该反应是放热反应。则反应温度升高,A的转化率减小。
(5)平衡常数只与温度有关系,所以压强的变化并不能改变平衡常数,即化学平衡常数K(A)=K(B)。
考点:考查平衡状态的判断、反应热的有关计算、平衡常数的有关计算和判断
点评:该题属于中等难度的试题,重点考查学生对平衡状态、平衡常数的理解。难点是平衡状态的判断,判断平衡状态的依据一般有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。

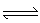 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。