题目内容
4.下列物质的水溶液,不存在电解质分子的是(水分子除外)( )| A. | HCl | B. | CH3COOH | C. | NH3 | D. | HF |
分析 物质的水溶液中,除水分子外,不存在其他分子,说明该溶质不是弱电解质、非电解质或能发生水解的盐,据此分析解答.
解答 解:A、HCl是强电解质,在水溶液中完全电离生成离子,所以不存在除了水分子外的其它分子,故A正确;
B、醋酸是弱酸,在水溶液中存在电离平衡,所以存在醋酸分子,故B错误;
C、氨气溶于水生成一水合氨,一水合氨为弱碱,存在一水合氨分子,故C错误;
D、HF是弱酸,在水溶液中存在电离平衡,所以存在HF分子,故D错误,故选A.
点评 本题考查电解质的电离及盐类水解,为高频考点,明确物质性质及盐类水解特点是解本题关键,知道哪些物质在水溶液中存在平衡,题目难度不大.

练习册系列答案
相关题目
15. 光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
 光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 该物质可稳定存在于碱性溶液中 | |
| C. | 1mol该物质最多可与3molH2发生加成反应 | |
| D. | 该物质可经过缩聚反应制得 |
12.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 过氧化钠的电子式: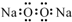 | |
| B. | “玉兔”号月球车上使用的质子数94,中子数144的钚原子:${\;}_{94}^{144}$Pu | |
| C. | CH4的球棍模型: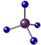 | |
| D. | Na的原子结构示意图: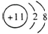 |
19.现有三组混合液:①汽油和水 ②乙醇和水 ③溴和水,分离以上各混合液的方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
9.已知:2NO2 ?N2O4△H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )


| A. | (1)中红综色变深,(2)中红棕色变浅 | B. | (1)中红综色变浅,(2)中红棕色变深 | ||
| C. | 烧瓶(1)中气体的压强不变 | D. | 烧瓶(2)中气体的压强增大 |
16.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
①容器a达平衡时N2的平衡浓度c(N2)=3mol/L.
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2000 |
| K | 3.84×10-31 | 0.1 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
13.能一次区分乙酸、乙醇、苯、溴苯四种物质的是( )
| A. | 水 | B. | 碳酸氢钠溶液 | C. | 石蕊试液 | D. | 硫酸氢钠溶液 |
14.下列实验描述符合事实的是( )
| A. | 钠暴露在空气中,表面变暗,生成白色固体氧化钠 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色固体 | |
| C. | 铜的化学性质很稳定,铜在任何条件下都不会生锈 | |
| D. | 用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,剧烈燃烧火星四射,放出大量的热,生成红棕色的固体 |